糖分子帮助胃细胞区分好坏虫
所有人中有一半长期感染幽门螺杆菌,这是一种革兰氏阴性细菌,在胃癌的发展中起着致病作用。它有两种类型,一种相对无害,另一种可将癌症风险增加六倍。危险的菌株通过激活核因子κB(NF-κB)引起胃粘膜中特别强烈的炎症,NF-κB是基于组织的先天免疫应答的“主开关”,其快速触发引发局部炎症的基因的转录。然而,幽门螺旋杆菌如何引发NF-κB长期以来一直是个谜。
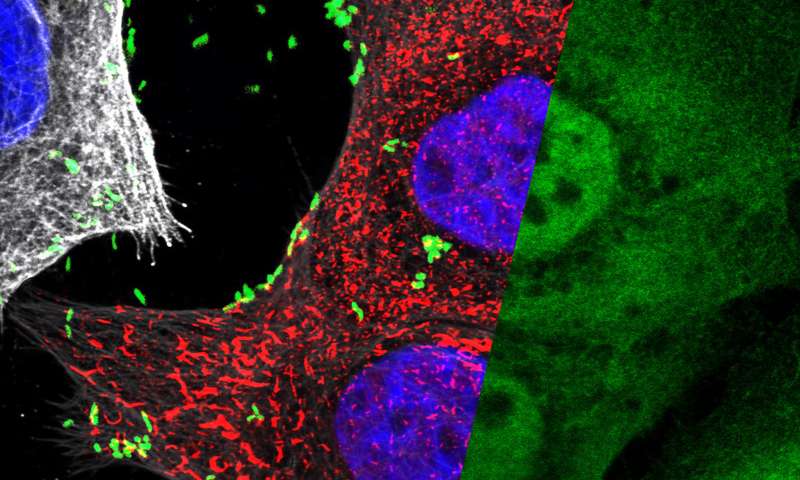
现在,柏林马克斯普朗克感染生物学研究所的一个研究小组已经证明,这种细菌只能在革兰氏阴性菌中发现一种叫做HBP的糖分子宿主细胞,革兰氏阴性菌通过一条新途径激活NF-κB。研究人员发现注射HBP可以快速组装非常大的复合物,即所谓的TIFAsomes,它含有大量蛋白质,有助于协调感染胃组织中的抗微生物炎症反应。
已知胃肠道的慢性炎症促进癌症的发展,因此理解启动和控制组织水平炎症的机制对人类健康具有重要意义。导致终身感染的幽门螺旋杆菌持续增加炎症反应。这样,病原体可引起胃炎和胃溃疡,并且是第一种被认为具有致癌性的细菌。有趣的是,存在或不存在IV型分泌系统(T4SS)存在两种主要菌株 - 细菌用于将分子直接注入宿主细胞,破坏其功能的机制。携带T4SS的菌株会导致更严重的炎症,更容易引起溃疡和癌症 - 至关重要的是,
几十年来,胃衬里的细胞如何能够区分这些高毒力和低毒力的幽门螺旋杆菌。到目前为止,注射的毒力蛋白CagA在宿主细胞中引发多重有害变化,是已知由幽门螺旋杆菌T4SS转位的唯一分子。科学家们自然地寻找这个分子找到答案,但无法确定一个允许免疫系统检测它的明确机制。
由位于柏林的马克斯普朗克感染生物学研究所的Thomas F. Meyer领导的研究小组决定采用RNAi干扰技术进行无偏见的全基因组方法,并研究哪些人类基因参与激活NF-κB。“特别是,与胃组织固有的其他炎症刺激相比,我们对感染后激活的基因感兴趣。我们怀疑所涉及的途径不同。”实际上,筛选鉴定了两种名为ALPK1和TIFA的独特分子,其仅响应于幽门螺杆菌感染而激活NF-κB。随后的研究表明,ALPK1激酶引起TIFA的磷酸化,然后引发大蛋白复合物的快速组装,称为TIFAsomes。这些复合物构成了与经典NF-κB途径的联系。“当我们使用荧光标记的TIFA对细胞进行延时显微镜检查时,我们惊讶于这些TIFA复合物的形成速度以及它们的大小,“Meyer教授说。”然后我们意识到这些TIFAsomes含有多少种不同的蛋白质。显然,他们在启动对感染的其他反应方面发挥了作用,我们尚不明白“。
然而,问题仍然是幽门螺旋杆菌如何启动这一系列事件。当另一组发现HBP(革兰氏阴性细菌脂多糖合成的糖分子前体)能够刺激TIFAsome形成时,研究小组测试了这种糖分子是否可能是幽门螺杆菌NF-κB活化的触发因素。实际上,他们观察到来自幽门螺旋杆菌的HBP可以激活TIFA,但是对于这种幽门螺旋杆菌需要有效的T4SS。认识到通过毒力相关的T4SS进行HBP的传递令人惊讶,因为它被认为仅转移CagA。由于T4SS已被公认为幽门螺旋杆菌毒力的主要决定因素,因此它特异性释放HBP的事实解释了我们的身体如何区分高致病性和低致病性菌株。没有T4SS的致病菌株。
推荐内容
-
8月7日越南胡志明市疫情最新数据公布 越南昨日新增新冠确诊8324例
你知道越南疫情目前什么情况吗?越南疫情有多少人确诊了?据消息显示,越南新增确诊8324例,河内现新感染群病例增加3倍再延长限制措施。据越
-
湖北汉川市一男子让多名女子同时怀孕 随后真相曝光一幕令人震惊
女子想要男子帮忙提携一下自己的朋友,没有想到男子一口答应,但随后真相曝光,令人震惊。想必今天大家最关注的话题莫过于男子让多名女子怀
-
上海,52+570!
上海,52+570! 原标题:上海,52+570! 上海市
-
早上“空腹”吃这4物,刮油排毒,脂肪哗哗“溜走”
早上“空腹”吃这4物,刮油排毒,脂肪哗哗“溜走” 原标题:早上“空腹”吃这4物,刮油排毒,脂肪哗哗“溜
-
武庚纪111集烧脑剧情 逆天而行即将下线
想必大家都知道,最强脑洞封神演义《武庚纪》,是由玄机科技与腾讯视频联合出品,是由杭州玄机科技信息技术有限公司根据香港封神漫画题材...
-
新研究表明 现在可以实现最高能量密度的全固态电池
来自东北大学和高能加速器研究组织的科学家开发出一种新的复合氢化物锂超离子导体,可以生产出迄今为止能量密度最高的全固态电池。研究...
-
两种情绪药物可对抗与先天缺陷有关的病毒
耶鲁大学医学院的研究人员发现,两种稳定情绪的药物可以预防与出生缺陷有关的潜在危险病毒以及免疫系统受损的人的疾病。相关药物缬氨酰...
-
上海高三初三开学 沪上校园迎来生机
上海高三初三返校,高校开学在即,你准备好了吗?在经历了史上最长寒假后,昨天上海的高三和初三学生终于迎来了复课开学的日子,沪上的各个
-
喝粥养胃吗?胃反酸烧心怎么办?
由于人们不注意平时的饮食习惯或者是先天脾胃功能就较差,胃病如慢性胃炎、胃溃疡等已经成为日常生活中常常会遇到的疾病之一。胃不舒服...
-
解码的基因组可能有助于乌龟赢得种族生存
踏实和稳重是赢得比赛的关键。虽然在伊索的经典寓言之一中可能也是如此,但莫哈韦沙漠龟可能需要比过去几十年更快地适应。该物种正面临...







