研究人员确定了与SirT6相关的新染色质调控机制
由ÀlexVaquero博士领导的Bellvitge生物医学研究所(IDIBELL)的表观遗传学和癌症生物学项目的研究人员提出了一种新的NF-κB途径调控机制,该机制与加速细胞衰老有关,基于分析SirT6蛋白的功能。他们的研究结果发表在Nature Communications上,表明抑制与SirT6对染色质作用有关的途径的双重机制。
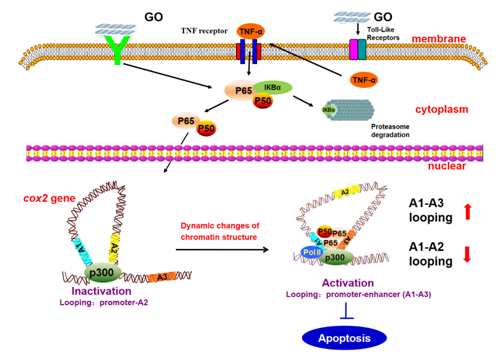
SirT6是一种sirtuin,一种参与细胞对压力反应的酶。具体而言,SirT6保护基因组的稳定性并调节代谢平衡(体内平衡),之前的研究表明,减少导致与NF-κB途径过度活化相关的加速衰老表型,NF-κB途径是调节细胞的转录因子家族。细胞对各种生理条件的反应,并在癌症,炎症反应和免疫系统中发挥关键作用。
到目前为止,一些假设表明SirT6将NF-κB通路的激活水平保持在低水平,特别是一旦接收到激活信号就阻断它。“然而,在我们的研究中,我们已经确定了与该调节相关的新机制,其中SirT6不仅在特定阻遏基因失活的水平上控制NF-κB,而且还控制该途径的一般阻遏物的激活,”该研究的第一作者ÀlexVaquero博士解释说。
由于与IDIBELL蛋白质组学科学技术支持部门合作开展的几项生化研究,研究人员观察了SirT6如何与Suv39h1相互作用,Suv39h1是一种能够在组蛋白的某个区域(H3K9me3)添加甲基的酶。SirT6促进由SKP2酶催化的Suv39h1(Suv39h1mUb)的单泛素化。这种修饰是特别令人感兴趣的,因为它发生在半胱氨酸残基而不是赖氨酸残基中,这种情况以前仅在极少数情况下观察到,并且主要在病毒或过氧化物酶体蛋白中。这是对高等真核生物中核因子的这种修饰的首次描述。
“泛素化的主要功能是通过添加许多单位的泛素来标记蛋白质,使其被蛋白酶体降解。”然而,在已发表的研究中,单泛素化发挥了另一个作用,因为它会干扰Suv39h1与染色质的结合,并导致该酶退出染色质,激活作为NF-κB通路抑制因子的基因,“Dr .Vaquero。
研究人员已经确定,这种新的SirT6依赖的NF-κB途径失活机制主要与细胞应激水平有关,但仍有尚未解决的问题。“这项研究为核蛋白质泛素化功能的研究开辟了一条新途径,并表明这些修饰的监管环境比以前预期的要复杂得多,”他说。
推荐内容
-
分子在治疗细菌感染方面显示出前景
低剂量的天然分子的合成聚合物可能有助于抑制肺炎链球菌和脑膜炎奈瑟球菌的致命细菌感染。身体抵御病原体的一个重要方法是通过补体系统...
-
河北省唐山市一嫌犯杀害2名女司机却人间蒸发 15年后直升机拍下令
真相是什么?据最新消息显示,近日就有一则关于5年前杀害2名出租司机嫌犯躲山洞,直升机搜捕嫌犯的消息引起了网友们的围观。具体是什么情况
-
新的工程纳米医学可以减缓骨骼癌症
一组研究人员设计了一种骨特异性纳米粒子,可以提供减少副作用的抗癌药物。药物递送系统旨在抑制多发性骨髓瘤患者的肿瘤进展。骨是肿瘤...
-
新的网络工具可以轻松估算基因树
基因树与家谱一样,追溯特定基因的谱系,从其深祖根到其仍然生长的分枝。通过比较基因树和物种树,它们绘制物种的进化历史,科学家可以...
-
验证RNA序列数据
一个国际联盟对公开提供的RNA测序数据进行了最全面的分析,为评估临床和基础研究中使用的此类数据的可靠性提供了独特的资源1。高通量转录组
-
人类基因组可能在确定人类胃肠道中数十亿种微生物的组成中起作用
来自瑞典,苏格兰和澳大利亚的一组研究人员认为,人类基因组可能在确定人类胃肠道中数十亿种微生物的组成中起作用,这些微生物被统称为...
-
确定了骨髓衰竭背后的新基因突变
端粒是保护染色体末端的DNA的短片段。每次细胞分裂时,端粒长度都会缩短。然而,未经检查的端粒缩短可导致细胞死亡 - 除非细菌和干细胞在
-
生物学家认为 物种发现的基因组工具会增加对物种数量的估计
根据两位密歇根大学进化生物学家的一项新研究,越来越流行的技术仅通过分析遗传差异来推断动物和植物中的物种边界是有缺陷的,并且可能...
-
现代驯养的马在过去的2300年里失去了遗传多样性
驯化青铜和铁器时代马的遗传分析显示出比现代后代更多样化和更少的有害突变。分析提供了对古代文化及其育种策略的洞察,并增加了我们对...
-
抗氧化剂可减缓植物的衰老
老龄化是一个复杂的过程,涉及许多不同的机制。老化所依据的主要过程之一是活性氧(ROS)的形成。ROS是由于氧的顺序单电子还原而形成的分子。