改善针对实体瘤的CAR T免疫疗法结果
研究表明,肉瘤和癌症已被证明对CAR T免疫治疗方法更具抗性,部分原因是工程化T细胞一旦渗入肿瘤就逐渐失去抗肿瘤能力。免疫学家称这种细胞疲劳T细胞“疲惫”或“功能障碍”。
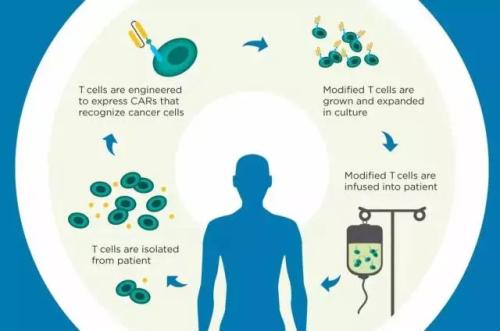
为了解原因,La Jolla免疫学研究所的研究人员Anjana Rao博士和Patrick Hogan博士在过去几年中发表了一系列论文,报道称一种调节基因表达的转录因子,称为NFAT,可转换下游基因这削弱了T细胞对肿瘤的反应,从而使T细胞衰竭。一组这些下游基因编码称为NR4A的转录因子,之前的研究生Joyce Chen表明,肿瘤浸润的CAR T细胞中NR4A蛋白的遗传消除改善了肿瘤排斥。然而,在该途径中与NFAT和NR4A合作的其他参与者的身份仍然未知。
在一项由Rao和Hogan实验室在线发表在PNAS上的研究(“ TOX和TOX2与NR4A转录因子配合以施加CD8 + T细胞衰竭”),一个更完整的基因表达网络参与者列表,建立和维护T-描述了细胞衰竭。该工作采用小鼠模型显示遗传上消除了两个新因子TOX和TOX2,也改善了CAR T模型中固体黑色素瘤的根除。该研究表明,针对患者的NR4A和TOX因子的可比较干预可以将基于CAR T的免疫疗法的使用扩展到实体瘤。
该小组首先比较正常和疲惫T细胞样本中的基因表达谱,寻找与NR4A平行上调的因子作为T细胞功能障碍的共同阴谋。“我们发现两种称为TOX和TOX2的DNA结合蛋白与NR4A转录因子一起高度表达,”Rao实验室博士后研究员Hyungseok Seo博士和该研究的第一作者说。“这一发现表明,像NFAT或NR4A这样的因素可能会控制TOX的表达。”
然后该小组首先在小鼠中重现CAR T方案,首先用黑素瘤肿瘤细胞接种动物以建立肿瘤,然后一周后给小鼠注射两种T细胞集合中的一种:来自正常小鼠的对照样品,而不是样品衍生自基因工程的小鼠,其在T细胞中缺乏TOX和TOX2表达。
输注TOX缺陷的CAR T细胞的小鼠显示出比输注正常细胞的小鼠更强烈的黑素瘤肿瘤消退。此外,用TOX缺陷的CAR T细胞处理的小鼠表现出增加的存活率,表明TOX因子的丧失对抗T细胞耗尽并且允许T细胞更有效地破坏肿瘤细胞。
进一步的分析使得研究人员走上了一条通向众所周知的免疫对手的道路。研究人员表明,TOX因子与NFAT和NR4A联合起来促进一种称为PD-1的抑制性受体的表达,PD-1可以修复疲惫的T细胞表面并发送免疫抑制信号。
PD-1被许多检查点抑制剂阻断,这些抑制剂可以抵抗免疫抑制并激活先天的抗癌免疫反应。研究小组表示,PD-1上TOX,NFAT和NR4A的融合使得分子和免疫学有意义,并将其置于细胞和抗体免疫治疗方法的汇合之中。
“目前,CAR T细胞疗法对患有'液体肿瘤'的患者表现出惊人的效果,如白血病和淋巴瘤,”Seo说。“但由于T细胞衰竭,它们仍然不适用于实体瘤患者。如果我们通过用小分子处理CAR T细胞来抑制TOX或NR4A,这种策略可能对黑色素瘤等实体癌症有很强的治疗作用。“
推荐内容
-
鱼类研究显示动物细胞中重要的基因组相互作
在一项新的研究中,迈阿密大学(密苏里州)罗森斯蒂尔海洋与大气科学学院的研究人员研究了动物细胞中两个基因组的相互作用 - 线粒体和核基
-
心理知识:过于敏感会影响你的心理健康
生活中,不管我们在跟自己独处还是跟别人相处的过程中其实我们会发现心理对一个人的影响是很大的。因此当我们发现自己有心理疾病的倾向...
-
发现编码抗癌药物的基因
许多海洋无脊椎动物的组织,例如海绵,被囊动物和其他滤食动物,含有产生各种生物活性化合物的微生物群,其中一些已被开发成临床上有用...
-
心理知识:每天学点冷知识(一)
今天也是照常给大家说说心理方面的常识。很多人提到心理这两个字是没有概念的,以为这个东西是不需要去在意的。其实不然,随着科学知识...
-
专属女性的糖尿病早期症状有哪些?
-2022年4月16日发(作者:草莓鼻怎么办)专属女性的糖尿病早期症状有哪些?糖尿病是一种严重的内分泌疾病,不管男女老少都可能患上这种病,而
-
人体究竟有没有“酸碱体质”?真实情况是怎样
相信很多人都被“误导”过。因为现在的网络信息非常丰富和更新迅速,还没等我们了解事情的详情,下一秒就又反转了。所以大家在获取信息...
-
专家:德尔塔毒株可能卷土重来
专家:德尔塔毒株可能卷土重来 中新社北京4月21日电 综合消息:世界卫生组织官网最新数据显示,截至欧洲中部时间20日17时50分,全球累计
-
怎么才算心理健康?
健康不仅仅是没有疾病或不虚弱,而是身体、心理和社会适应的完好状态。心理健康是健康的重要组成部分。老年人想要心理健康,应该朝着哪...
-
国内外GI标识情况?科学观点是说...
日常生活中我们经常会听到各种各样的坊间流言。然而很少人去求证这些流言的真实性,久而久之就变成了真事。在这里,小编必须提醒大家,...
-
【新阶层 新助力】石家庄市元氏县新联会慰问防疫工作人员
【新阶层 新助力】石家庄市元氏县新联会慰问防疫工作人员 正值“五一”假期,战“疫”仍在继续。5月4日上午,河北省石家庄市元氏县县...




