为正确的功能选择合适的基材
东京工业大学的科学家发现了一种独特的分子机制,负责泛素特异性蛋白酶的底物偏好。泛素是一种小的,高度保守的真核调节蛋白,可通过异肽键与细胞内蛋白上的Lys残基连接。遍在蛋白还可以附着于其他遍在蛋白部分的七个Lys残基之一,在靶蛋白上形成多泛素链。取决于遍在蛋白中的哪些Lys用于形成多泛素链,发生不同的信号传导功能。因此,Lys48连接的多聚泛素化是细胞中最丰富的,导致靶蛋白的蛋白酶体降解,而Lys63连接的多泛素化调节多种细胞活性,如蛋白质贩运和DNA修复。泛素化是可逆的,因为形成的异肽键可以被去泛素化酶切割,所述去泛素化酶有时对Lys48-和Lys63-连接的遍在蛋白链表现出不同的偏好。然而,去泛素化酶对Lys48-连接的遍在蛋白链的底物特异性的分子机制仍然很大程度上未知。
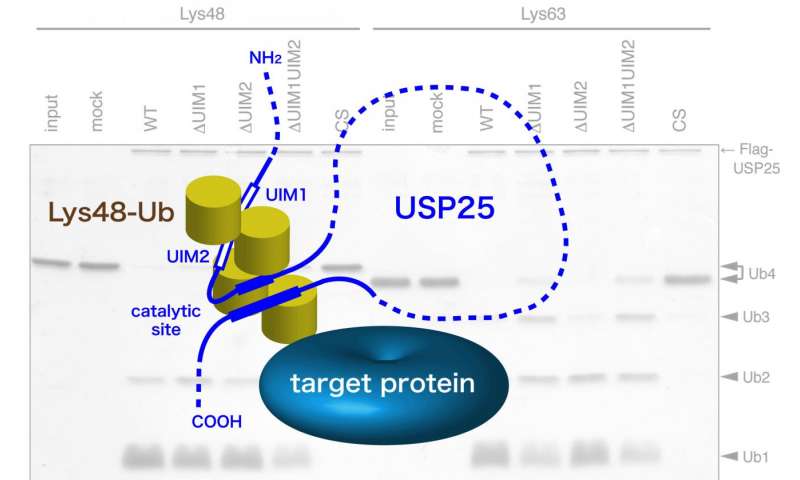
由Masayuki Komada教授领导的东京工业大学的研究人员通过研究泛素特异性蛋白酶(USP)25的功能来解决这个问题,该研究发现该研究有利于Lys48连接的切割。USP25含有两个代表20个氨基酸α-螺旋的串联遍在蛋白相互作用基序(UIM)。为了测试UIM介导的结合是否导致底物偏好,这些科学家产生了一组USP25突变体,其在UIM中携带功能性氨基酸的取代并分析它们与Lys48-或Lys63-连接的遍在蛋白链的相互作用和催化活性。似乎串联UIM不仅增强了USP25的肽酶活性,而且还确定了其优先切割Lys48-连接的遍在蛋白链。
这些发现提供了去泛素化酶的第一个实例,其中底物对Lys48-连接的遍在蛋白链的偏好由UIM决定。科学家们认为UIM通过将Lys48连接的泛素链保持在酶的活性位点附近而在催化机制中发挥作用。与Lys48连接的泛素链复合的USP25的未来结构研究应该确定是否确实如此。
推荐内容
-
心理知识:经常生气的危害有哪些
现实生活中,我们很难揣测出一个人的心理活动。但是我们可以根据一些知识的细节,去假设判断一些人的心理,也包括对自己的心理的认知。...
-
女子如厕竟被马桶炸伤?大家都想知道
生活中我们经常会听见各种各样的流言,但是只要我们用心去思考和辨认其实 不难发现这些谣言有很多破绽。所以今天,小编照常给大家辟谣一则
-
时刻警惕“无形杀手”!家庭防范要注意四个地方
近日,广东珠海一家四口中毒陷入昏迷,消防员上门采取紧急急救措施后,在厨房检测到一定浓度的一氧化碳。一氧化碳无色无味,很难被人察觉
-
山东新增本土确诊病例6例及本土无症状感染者66例
中新网4月27日电 据山东卫健委微信公众号消息,2022年4月26日0时至24时,全省报告新增本土确诊病例3例,均在济南。新增本土无症状感
-
夏练三伏好处多?真的假的?
生活中我们经常会听见各种各样的流言,但是只要我们用心去思考和辨认其实 不难发现这些谣言有很多破绽。所以今天,小编照常给大家辟谣一则
-
心理知识:让孩子尽情地看大人洗澡
现实生活中,我们很难揣测出一个人的心理活动。但是我们可以根据一些知识的细节,去假设判断一些人的心理,也包括对自己的心理的认知。...
-
商家给螃蟹“打针”来保鲜、增重?实际是这样...
面对流言,希望我们第一时间想到的是寻找官方回应。而不是着急着把流言传播出去,毕竟现在网络相关的法律法规都出台了,网络上传播谣言...
-
基因组医学和公共卫生中的新生儿测序
基因组测序技术的快速发展已经降低了遗传分析的成本,以至于基因组规模测序可能在儿科护理中具有广泛的可用性似乎是合理的。基因组测序...
-
广东新增本土确诊病例3例
中新网4月25日电 据广东卫健委微信公众号消息,4月24日0-24时,全省新增本土确诊病例3例,均为广州报告。全省新增出院17例(境外输入2
-
基因疗法修复猪的心脏病发作
一小块遗传物质microRNA-199a已用于刺激大型哺乳动物猪的心脏修复。通过注射到心肌组织中的腺相关病毒载体递送,microRNA导致心肌梗塞几乎