通用钳夹蛋白稳定折叠蛋白 对伴侣蛋白Hsp70如何工作的新见解
10月26 日, 大自然将发表一项研究,推翻了几十年前的一种蛋白质动作模型,该蛋白质对于活细胞中的许多过程至关重要。FOM研究所AMOLF和海德堡大学的研究人员表明,蛋白质Hsp70可以使用可移动的盖子机械稳定折叠的蛋白质,从而保护它们免受压力和损伤。这种对蛋白质如何相互帮助的见解,提供了对多种细胞功能的新视角,并最终可以更好地了解癌症和帕金森氏症等疾病,其中蛋白质系统失效是其中心。
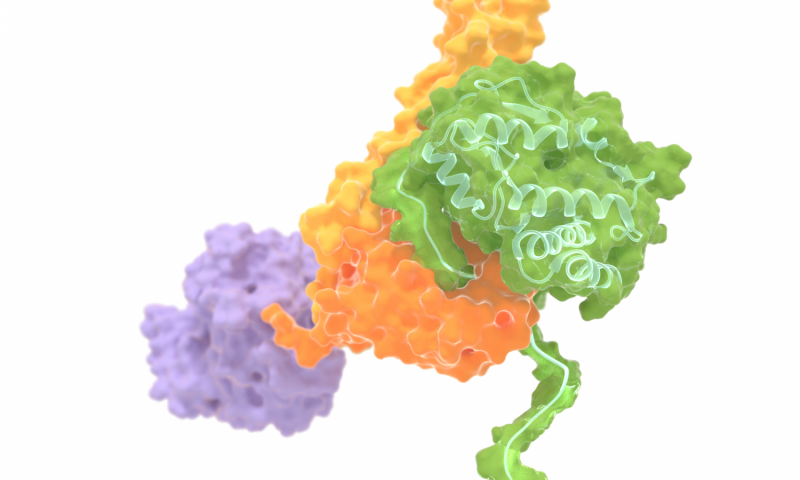
“蛋白质共同控制活细胞中的几乎所有过程。它们短暂结合,可能催化反应,然后再次释放。大多数蛋白质具有特异性结合位点和特异性结合配偶体,但有些具有更普遍的功能”,Sander Tans解释说。调查这种伴侣蛋白作为AMOLF生物物理学组的负责人。“将它与工具进行比较:你可以使用特定工具来完成某些任务,但使用通用工具可以解决几项任务。伴侣蛋白就像一种通用工具,可以与任何其他蛋白结合,帮助或阻碍其功能。”
破坏单一蛋白质
Tans和他的同事使用光学镊子设置来研究HsP70的功能。他说:“通过这种技术,我们可以采集一种蛋白质,并以非常可控的方式对其进行破坏,只需拉动它 - 就像折磨蛋白质一样”。“通常这会使蛋白质分开,我们称之为展开。令我们惊讶的是,我们发现Hsp70能够保护蛋白质并使其保持几乎完整。当Hsp70结合时,几乎不可能拉伸和损伤折叠的蛋白质。 “
这是一个令人惊讶的结果,因为Hsp70的教科书模型说,伴侣蛋白喜欢与延伸的肽链结合。当蛋白质首次制造或受损时,这些链会暴露出来。因此,根据现有模型,Hsp70稳定蛋白质的拉伸和未折叠状态,但不稳定肽链折叠的折叠状态。
自动机械夹具
“这个伴侣是一个非常复杂的系统”,Tans说。“当它燃烧燃料分子ATP时,Hsp70大大改变了它的形状,就像燃烧燃料的汽车发动机一样。蛋白质的一部分充当打开和关闭的盖子或杠杆。通常这种运动进行得非常快,所以我们停止了我们发现,当我们添加大量水解的ATP分子(称为ADP)时,Hsp70长时间结合并稳定蛋白质。这是有道理的,因为我们从生物学中知道当细胞受到应激时及其蛋白质需要保护,ADP确实积累。在其他实验中,我们也看到蛋白质对高温具有抗性,因此在HsP70存在下更稳定。“
更好地了解蛋白质
这项研究表明,现有的HsP70工作模式需要进行调整。“我们应该从不同的角度来看待这个伴侣在细胞中的许多功能。
例如,我们的结果表明,Hsp70可以真正驱动折叠本身,而不仅仅是阻止暴露的蛋白质链之间的聚集。此外,我们发现的工作机制可能允许Hsp70直接结合折叠的受体,从而调节其活性“,Tans说。”通过更好地了解HsP70的作用以及涉及哪些部分,我们最终可以更有效地寻找修复方法在许多条件下蛋白质过程失败,它起着重要的作用。“
推荐内容
-
王珊珊是谁个人资料简介 女足王珊珊多大哪里人经历背景介绍
【导读】王珊珊是谁?据消息显示,王珊珊女,1990年1月27日出生于河南洛阳,中国女子足球运动员,司职前锋。大连权健女子足球运动员,效力于
-
51凡先生是什么意思什么梗?为什么叫51凡梗出处含义介绍
娱乐圈真是个只有想不到没有不可能的地儿啊~今天,小编就带大家来了解下娱乐圈今日份最热门的大瓜吴亦凡事件吧。51凡是什么梗一、梗介绍51
-
周六福2022金价今日价格多少钱一克?香港周六福铂金今日价格多少钱
今日黄金价格及今日金价查询(黄金首饰价格多少一克,今日黄金首饰价格走势,黄金饰品价格多少一克查询),想必这两天大家最关注的就是金价一事
-
陈伟霆盔甲造型 束起高马尾少年感十足
陈伟霆盔甲造型
-
共生的纤毛虫和细菌有共同的祖先
纤毛虫,就像人类一样,被多种多样的细菌所殖民。一些纤毛虫和它们的细菌共生体已经成为终生的朋友,因为来自不来梅马克斯普朗克海洋微...
-
11月8日西安疫情最新数据公布 陕西昨日新增1例境外输入无症状
疫情期间,严格注重个人卫生习惯。养成人群聚集和密闭场所佩戴口罩,勤洗手、公筷制、分餐制,咳嗽打喷嚏时注意遮挡等良好卫生习惯。陕...
-
热爱105度的你什么意思什么梗?热爱105℃的你怎么火起来的写了什么
【 热爱105℃的你什么梗 】关于热爱105℃的你什么梗?热爱105°C的你在线听的这个话题,相信小伙伴们是非常有兴趣了解的,因为这个话题是
-
北京冬奥村具体是干什么的 北京冬奥村位于哪里?
北京冬奥村
-
凡尔赛文学什么梗 凡尔赛文学朋友圈一人一句凡尔赛文学怎么发?
【导读】凡尔赛文学是什么,凡尔赛文学是谁?凡尔赛文学是什么意思出自哪里?今天小编就来帮助大家了解一下凡尔赛文学到底是什么,以及圈...
-
11月17日大连金普新区疫情最新数据公布 大连昨日新增8例本土确
辽宁大连市发布新增8例本土确诊病例行程轨迹。那么,对于大连疫情的这个话题,今天的你是否也在关注着?具体什么情况?下面跟小编一起来了解