吉利德Yescarta治疗大B细胞淋巴瘤
美国制药巨头吉利德(Gilead)近日宣布,加拿大卫生部已批准嵌合抗原受体T细胞疗法(CAR-T)Yescarta(axicabtagene ciloleucel,KTE-C19),用于既往接受二线或多线系统治疗的复发性或难治性大B细胞淋巴瘤(LBCL)成人患者的治疗,包括弥漫性大B细胞淋巴瘤(DLBCL)、原发纵膈大B细胞淋巴瘤(PMBCL)、高级别B细胞淋巴瘤(HGBL),以及源于滤泡性淋巴瘤(FL)的DLBCL(即转化型FL,TFL)。该药不适用于原发性中枢神经系统淋巴瘤患者的治疗。
Yescarta将由吉利德旗下公司Kite制药公司生产。在ZUMA-1临床研究中,Yescarta的制造成功率为99%,平均制造周期为17天。
Yescarta的获批,是基于关键性临床研究ZUMA-1的积极数据。该研究中,共计101例患者接受了Yescarta单次输注,总缓解率为72%(n=73/101)、完全缓解率为51%(n=52/101;有独立审查委员会评估,中位随访15.4个月)。安全性方面,该研究中有12%的患者经历了3级或更高级别的细胞因子释放综合征(CRS),31%的患者经历了3级或更高级别的神经系统不良反应。
ZUMA-1研究的研究员、加拿大玛格丽特公主医院内科肿瘤血液科医师John Kuruvilla表示,“CAR-T疗法是个性化医学和淋巴癌治疗的前沿。Yescarta的获批,是一个重大的里程碑,将为加拿大的复发性或难治性大B细胞淋巴瘤患者提供新的希望,该药是一种完全为每例患者量身定制的可信赖产品。”
值得一提的是,今年1月中旬,诺华的CAR-T细胞疗法Kymriah(tisagenlecleucel,CTL019)也获得加拿大卫生部批准,用于2种B细胞恶性肿瘤:(1)年龄在3-25岁的B细胞急性淋巴细胞白血病(B-ALL)儿童和年轻成人患者;(2)复发性或难治性(R/R)大B细胞淋巴瘤(LBCL)成人患者。此次批准,使Kymriah成为加拿大批准的首个CAR-T细胞疗法,标志着癌症治疗新时代的开启。
非霍奇金淋巴瘤(NHL)是加拿大第五大最常见癌症。2017年,估计有8300例新诊NHL患者,2700例患者死亡。DLBCL是最常见的侵袭性NHL,约占NHL的30-40%。从历史数据来看,当采用目前的标准护理治疗时,难治性DLBCL的中位总生存期(OS)仅为6个月,只有7%的患者能实现完全缓解。目前,接受二线和多线治疗的DLBCL患者预后很差,因为近半数的患者在移植后不久失去治疗反应或病情复发,因此该领域存在着远未满足的巨大医疗需求。
截至目前,在全球范围内,已有2款CAR-T细胞疗法获批上市,即诺华的Kymriah和吉利德的Yescarta。与常规的小分子或生物疗法不同,它是一种活的T细胞治疗产品。Kymriah和Yescarta的原理均是将患者的T细胞进行基因修饰表达一种旨在靶向抗原CD19的嵌合抗原受体(CAR),CD19是一种表达于多种血液肿瘤细胞表面的抗原蛋白,包括B细胞淋巴瘤和白血病细胞。在输注患者体内后,Kymriah和Yescarta就能找到并攻击正常T细胞无法检测到的表达CD19的癌细胞。
推荐内容
-
科学家们揭示了寨卡病毒对一种脑细胞的攻击性影响
2015年巴西寨卡病毒(ZIKV)的爆发引起了许多机构和健康科学家的注意,他们认为这种病原体与小脑和其他胎儿神经系统疾病有关,统称先天性...
-
为临床研究提供新的基础编辑技术
地平线发现Group plc)(伦敦:HZD)(“地平线”,“公司”或“集团”),一个全球领先的基因编辑和调制技术的应用,今天宣布,它将提供一种新型...
-
基因组的空间配置不是遗传的而是在胚胎发生过程中建立的
构成每个细胞核基因组的DNA-蛋白质复合物的结构调节早期胚胎发育的过程。HelmholtzZentrumMünchen和LMU与Hubrecht研究所合作的研究人
-
实验性寨卡疫苗可改善猕猴模型中的胎儿结局
根据《科学转化医学》的一项新研究,在先天性寨卡病毒感染的恒河猴模型中,实验性寨卡疫苗降低了怀孕猴子的病毒水平并改善了胎儿结局。...
-
福报人生正心正念正行,读懂“负债越多,赚钱越多”
时下,一个名为福报人生的培训平台里,成功实现债务翻转的学员都在讲述自己的成功经历,让更多的人远离负债,过上幸福的生活。下面跟随记者一起
-
阳春三月万物苏 爱提力螯合钙和同源D3已为你的孩子长高铺好路
阳春三月,草长莺飞,这是一个万物生长的季节。世界卫生组织的有关专家调查发现,孩子的身高发育也有显著的季节性,其中春季是长个子最快的季节
-
新型化学探针可实现脑免疫细胞的实时成像
韩国和新加坡的研究人员首次开发出一种化学探针,可以对活体动物大脑中的一种叫做小胶质细胞的免疫细胞进行实时成像。这一发现由韩国浦...
-
根据单细胞分子研究进行生物学教育
随机过程通常以随机的方式呈现,即不可预测的事件。这种框架模糊了这样一个现实,即随机过程虽然在个别事件层面上或多或少是不可预测的...
-
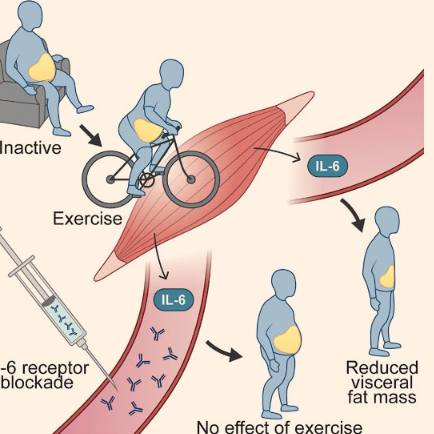
新研究表明运动如何减少腹部脂肪量
腹部(腹部)脂肪对代谢健康有害。运动训练可减少腹部脂肪量,但其潜在机制尚不清楚。根据发表在《细胞代谢》杂志上的一项新研究,称为白...
-
皮肤护理师毛赫男,告诉你必知的肌肤小知识
对于现代人来说,美丽,精致已经是这个时代的一大标签,无论男女。而对于美的追求,女性更是愿意把它当做自己一生的事业。在崇尚个性的...