Sarepta以1.65亿美元收购Myonexus 扩大肌肉萎缩基因治疗管道
Sarepta Therapeutics今天表示计划以1.65亿美元收购Myonexus Therapeutics,并在去年由该公司推出的基因治疗合作下进行购买。
这笔交易旨在扩大Sarepta与五位Myonexus候选人的管道。所有这五个人都使用从Nationwide儿童医院获得许可的相同基因治疗平台,该系统旨在全面且稳健地为心脏和骨骼肌(包括膈肌)提供治疗,而不会混杂地穿过血脑屏障。
所有五种基因治疗候选者被设计为首先提供五种不同形式的肢带肌营养不良症(LGMD)-LGMD2B,LGMD2C,LGMD2D,LGMD2E和LGMD2L的矫正治疗。
五个项目中有三个处于临床阶段。最快的发展是Myonexus的MYM-101用于LGMD2E,LGMD2E是一种基因治疗候选药物,旨在转移编码和恢复β-sarcoglycan蛋白的基因,目的是恢复肌营养不良蛋白相关蛋白复合物。
MYO-101使用AAVrh.74载体系统,这是在Louise R. Rodino-Klapac博士实验室开发的技术,她在全国儿童医院担任肌肉营养不良基因治疗研究的负责人; 她于2018年6月被Sarepta任命为基因治疗副总裁。该医院持有基因治疗候选人的IND申请。
除了AAVrh.74载体系统外,MYO-101还使用了MHCK7启动子,该启动子仅用于打开肌肉细胞中的基因。根据Sarepta的说法,MHCK7启动子已经被选择用于五个LGMD程序中的三个,因为它通常比其他肌肉肌酸激酶(MCK)启动子在肌肉中更有生产力并且在心脏中强有力地表达,这对于LGMD2E患者来说是至关重要的。以及LGMD2B和LGMD2C,其中许多人死于肺部或心脏并发症。
2018年11月,Myonexus宣布推出MYO-101(NCT03652259)的第一期人体I / IIa期试验。安慰剂对照研究旨在评估LGMD2E患儿中单次静脉输注MYO-101,年龄为4至15岁,患有明显的疾病症状。该研究旨在评估9名患者的两个队列中基因治疗候选人的最多两个剂量水平,其基线测量基于招募研究(NCT03492346)确定。
Myonexus管道的下一个最先进的是MYO-102,一种治疗LGMD2D或α-sarcoglycanopathy的方法。FDA于1月份批准了其MYO-102的孤儿药物指定,并要求进行初始肌内(IM)I期研究和孤立肢体灌注(ILP)I / IIa期研究以评估安全性。
Myonexus引用了MYO-102的早期临床研究,该研究显示使用基因治疗候选物的α-sarcoglycan蛋白的安全性和表达。根据Myonexus,用MYO-102治疗后,α-sarcoglycan表达相对于基线增加,蛋白质存在于肌肉中,如治疗后6个月的活组织检查所示。
双向矢量方法
同样到达临床的是MYO-201,一种LGMD2B的基因疗法,也称为dysferlinopathy,旨在永久性地使肌肉细胞产生关键的dysferlin蛋白,同时静脉注射两种载体,每种载体含有约一半的基因。
根据Myonexus的说法,MYO-201被设计成两个半自组装成一个完整的完整功能基因,其启动子只能打开肌细胞中的基因。该公司引用了Rodino-Klapac实验室的dysferlin生产缺陷小鼠模型的研究,该模型显示在治疗后测试的所有肌肉中都存在广泛的dysferlin表达。
FDA批准了一项IND,允许在LGMD2B患者中IM给予双载体基因治疗。Myonexus表示将提交修改IND的请求,以进行LGMD2B患者的全身静脉注射
Sarepta与Myonexus合作的其余两个项目都是临床前的:
MYO-103,旨在通过静脉注射含有γ-肌聚糖基因的载体和仅在肌肉细胞中打开基因的启动子,使肌肉细胞永久性地产生关键的γ-肌聚糖蛋白,从而治疗LGMD2C或γ-肌肉病。 ;
MYO-301,用于治疗LGMD2L或ANO5相关的肌肉疾病或血管病变,通过永久性使肌肉细胞产生关键的anoctamin蛋白,静脉注射含有anoctamin 5基因的载体和仅启动基因的启动子肌肉细胞。
“我们很高兴收购Myonexus,这将使我们能够迅速寻找LGMD患者的解决方案,并继续建立和验证我们的基因治疗引擎,”Sarepta总裁兼首席执行官Doug Ingram在一份声明中说。“开发的五种LGMD基因疗法非常适合Sarepta的使命,即开发具有拯救严重限制生命的罕见遗传疾病患者生命的治疗方法。”
英格拉姆表示,Sarepta对Myonexus计划的信心来自于我们的微肌营养不良蛋白基因治疗与Myonexus计划有许多共同之处的共性,包括来自Nationwide儿童医院的发明者,AAVrh74的共享载体,迄今为止,类似的临床前安全性数据。
Myonexus合作计划是Sarepta管道中13个基因治疗候选者中的5个,其中还包括6种基于该公司的肽二磷酸酰胺吗啉寡聚物(PPMO)平台的RNA靶向治疗,以及基于其磷酰二胺吗啉代寡聚物的5种RNA靶向治疗( PMO)平台。
在PMO疗法中,Exondys 51™(eteplirsen)在2016年获得了FDA首次批准用于治疗Duchenne肌营养不良症(DMD)。Exondys 51适用于DMD,适用于外显子51跳跃。FDA批准Exondys 51,尽管两个咨询委员会建议不要批准治疗和一些管理员的反对 - 其中一个随后从联邦政府退休。
Myonexus总裁兼首席执行官Michael Triplett博士补充说:“我们与Sarepta合作不到一年,因为我们共同为代表患有衰弱和致命疾病的患者开发LGMD疗法的共同目标。” “此次收购巩固了代表目前没有治疗方案的患者快速推进治疗的承诺。”
推荐内容
-
大肠杆菌 下一代疫苗的理想运输方式
大多数人在考虑摄入大肠杆菌时会退缩。但是,如果吸引标题的细菌可以用于对抗疾病呢?研究人员试验无害的大肠杆菌菌株 - 是的,大多数大肠
-
欧洲多国相继报告儿童不明原因急性肝炎 欧洲疾控中心:确切原因
欧洲多国相继报告儿童不明原因急性肝炎 欧洲疾控中心:确切原因尚不清楚 据法新社报道,此前,英国和西班牙发现不明原因急性肝炎病例
-
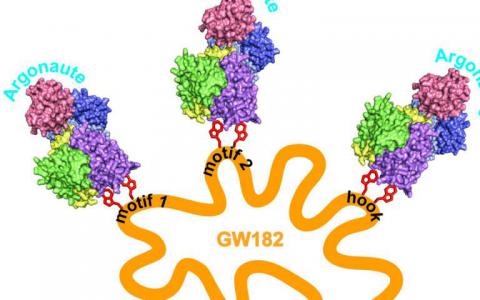
结构观点表明RNAi在抑制基因表达方面的作用倍增
在我们的生命中,我们的细胞不断表达基因。这是制造蛋白质的第一步,身体中所有结构的东西和无数戏剧中的分子参与者每秒都展开,因为细...
-
国家卫健委权威回应
国家卫健委权威回应 国家卫健委就不明原因儿童急性肝炎权威回应:目前我国尚未发现不明原因儿童急性肝炎记者从国家卫健委获悉,近期,
-
什么是破窗理论
心理活动是每个人都有的。然而这样一个别人不知道的思想角落,往往容易被他人忽视。所以我们自身必须时刻关注自己的内心需求,不能让自...