两剂埃博拉疫苗方案在早期临床试验中显示出希望
在1期临床试验中,使用两种候选埃博拉疫苗的免疫方案是安全且耐受良好的,并且可以在健康的成年志愿者中诱导免疫应答。该研究的结果在4月19日的“美国医学协会杂志”中有所描述。美国国立卫生研究院(NIH)的一部分,美国国家过敏和传染病研究所(NIAID)支持开发和测试两种研究疫苗:Crucell Holland BV开发的Ad26.ZEBOV和MVA-BN- Filo,由巴伐利亚北欧人开发。
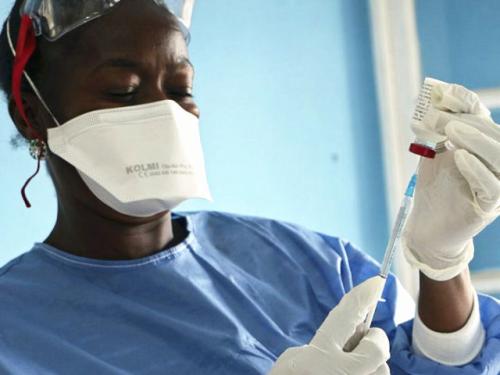
Ad26.ZEBOV疫苗使用腺病毒载体或载体来传递扎伊尔埃博拉病毒(该病毒是造成2014-2015年西非爆发的病毒)的遗传物质,从而促使人体做出免疫反应。MVA-BN-Filo疫苗的工作原理相似,使用改良的痘苗病毒安卡拉载体(MVA)传递相同的埃博拉病毒遗传物质,以及苏丹埃博拉病毒,泰伊森林埃博拉病毒和相关的马尔堡病毒的插入片段。腺病毒是人类轻度呼吸道疾病的常见病因,而牛痘病毒MVA是痘苗病毒(一种痘病毒)的弱化版本,已经成功地作为实验疫苗平台进行了测试。
该试验于2014年12月至2015年10月由牛津大学的科学家在英国进行,招募了87位18至50岁的健康成年人。研究人员将72名参与者随机分为4组,每组18人。在第一天,每组三人接受盐水安慰剂,其他15人接受Ad26.ZEBOV或MVA-BN-Filo注射。然后,参与者在28天或56天后与其他候选疫苗或第二个安慰剂一起接受加强剂量。参加非随机分组的第五组15名参与者在第一天接受了Ad26.ZEBOV疫苗。在这一组中,有14名参与者在14天后接受了MVA-BN-Filo研究性疫苗;三名参与者没有得到提升。
研究人员发现,Ad26.ZEBOV和MVA-BN-Filo研究用疫苗都是安全的,不会引起与疫苗相关的严重不良反应。所有先接种Ad26.ZEBOV疫苗(主要),然后接种MVA-BN-Filo作为加强疫苗的参与者,均在免疫后八个月发展并维持了埃博拉抗体,并且同一组中约80%的人也维持了疫苗诱导T细胞,帮助身体抵抗感染。这种持久的保护措施在埃博拉疫情间歇爆发的地区可能很重要,以便为社区提供基线保护。该疫苗 全球范围内的各种临床试验都在进一步测试这些方案,包括NIAID支持的Crucell Holland BV的1期试验,该试验正在马里兰州罗克维尔市进行。
推荐内容
-
术中低体温预防好点的标题
-2022年4月16日发(作者:潮州妇科医院)在四大生命体征(T、P、R、Bp)中,体温是排在最前位的一个,但也是我们最容易忽略的一个。低体温是
-
中医治疗糖尿病的疗效评价
-2022年4月17日发(作者:脑干梗塞)龙源期刊网中医治疗糖尿病的疗效评价作者:蔡君来源:《中西医结合心血管病电子杂志》2015年第04期【摘要
-
园林植物彩斑现象形成机理及原因
-2022年4月24日发(作者:怀孕一周的症状)・专题综述・ 北方园艺2014(03):182~186 园林植物彩斑现象形成机理及原因 刘晓
-
9月16日厦门疫情最新数据公布 厦门昨日新增本土确诊病例12例
当前疫情防控形势仍然严峻复杂,要紧绷疫情防控常态化这根弦,始终保持警惕、严密防范。从当下全国各地的疫情形势来看,似乎已经迎来了好...
-
英国野生蝾螈物种现在不含肉食真菌
一项全国范围的调查发现,英国的野生蝾螈种群似乎没有一种肉食致命的真菌,这种真菌在西欧的私人两栖动物中很普遍。来自国际保护慈善机...
-
今年国庆节加班7天工资怎么算?哪天是有三倍工资呢?
加班费,指劳动者按照用人单位生产和工作的需要在规定工作时间之外继续生产劳动或者工作所获得的劳动报酬。国庆节马上就要到了,相信大家还
-
8月20日广州天河区疫情最新实时消息公布 天河区一涉新冠疫情封控
【摘要】今天的你是否有在关注广州疫情的话题呢?你知道是什么情况吗?下面跟小编一起来了解下天河区一涉新冠疫情封控区调整为警戒区的具...
-
胃疼恶心呕吐的症状
-2022年4月24日发(作者:面部皮炎)如对您有帮助,可购买打赏,谢谢胃疼恶心呕吐的症状导语:胃疼恶心呕吐这种情况在我们的生活中是比较常见
-
等离子射频消融术治疗小儿鼾症的效果观察
-2022年4月16日发(作者:太冲准确位置图和作用)等离子射频消融术治疗小儿鼾症的效果观察目的:探讨低温等离子射频消融术治疗小儿鼾症的临床
-
(完整版)民间治高血压的偏方集锦
-2022年4月16日发(作者:健康生活小常识)民间治高血压的偏方集锦经常吃些大蒜:每天吃2—3瓣大蒜,是降压的最好的简易办法,对一组415人的



