临床试验研究合同
-
临床试验研究合同
合同类型:临床研究主协议
/补充协议
版本日期:版本号:
研究名称:
方案编号:
申办者:
CRO:
甲方(委托人):
法人:
联系地址:
:
传真:
:
E-mail:
项目负责人:
乙方(临床研究单位):上海交通大学医学院附属新华医院
专业组(科室):
联系地址:
:
传真:
双方关系
甲方为独立的法人机构,依中国人民共和国法律设立并在法律授权范围内开展
具体活动。甲方委托乙方开展本合同合作范围内的临床试验。
乙方是上海交通大学医学院附属新华医院内部从事临床试验的专业机构。依据授权
代表医院与甲方开展项目合作。
双方责任与义务
甲方:
1.免费向乙方提供研究用文件夹、临床试验方案、试验材料、受试者知情同意书、
病例报告表(CRF)、严重不良事件记录表等。
2.甲方负责对乙方的研究人员进行该临床研究有关的培训。
主要研究者:
:
E-mail:
3.在临床试验进行期间,负责派遣临床监查员对临床试验进行定期和不定期的监
查,并就监查中发现的问题与乙方协商解决。
4.甲方负责向乙方收回剩余试验用药。
5.甲方负责对临床试验结果进行数据统计并完成统计分析报告。
6.甲方应与研究者迅速研究所发生的严重不良事件,采取必要的措施(包括在有关
专家对不良事件与试验药物关系的判定前,根据先行垫付原则,支付受试者相
关的治疗费用),以保证受试者的安全和权益,并及时向药品监督管理部门报告,
同时向涉及相同研究药物的临床试验的其他研究者通报。
7.对于发生与试验相关(包括无法判定不良事件是否与试验药物有关)的损害或死
亡的受试者,承担治疗费用及相应的经济补偿,并向研究者提供法律上与经济
上的担保,但由医疗事故所致者除外。
8.如研究者违反本临床试验方案和医疗常规治疗手段,使受试者遭受不必要的损
害而导致的医疗费用,甲方及申办者不予承担。
9.组织临床试验方案讨论会、中期分期、总结会等,书面邀请乙方相关人员参加,
并承担相应食宿、交通费用;
10.签署并遵守廉政告知书内容;
乙方:
1.乙方应严格遵循GCP要求及研究方案进行本次临床研究。
2.乙方在合同规定的试验期限内完成有效病例的临床观察并提供填写完整的病例
报告表(CRF)。
3.试验进行中或结束后,乙方有责任向甲方监查员或审查员出示与本试验有关的
全部临床研究资料(包括原始记录、CRF、化验报告及其它检查报告等),以便
完成对试验的监查与审核
4.研究者负责作出与临床试验相关的医疗决定,保证受试者在试验期间出现不良
事件时得到适当的治疗。研究者有义务采取必要的措施以保障受试者的安全,
并记录在案。在临床试验过程中如发生严重不良事件,研究者应立即对受试者
采取适当的治疗措施,同时报告药品监督管理部门、申办者和伦理委员会,并
在报告上签名及注明日期。
5.乙方在收到申办者的数据处理组织对病例报告表的询问表后,应及时提供反馈
信息,一般情况下不应超过一周;
6.乙方在收到统计分析报告后,如无异议,应在3周内完成临床试验总结报告及
分中心小结表;
7.如有需要,负责参加CFDA专家审评会。按GCP要求保存试验相关资料;
8.乙方要严格遵守保密协议,未经甲方正式书面同意,不得公开发表包含本临床
试验信息的文章等发表物。
9.签署并遵守廉政告知书内容;
知识产权和保密
甲乙双方都应对受试者信息、文件资料等保密,本试验数据和结果的知识产权为甲
方所有,未上市前对试验结果和数据保密如乙方研究者发表文章等,需获得甲方批
准。
研究资料保存
根据GCP规定,研究机构保存药物临床试验资料的期限为研究结束五年,保
存器械临床试验资料的年限为10年,如需延长保存,机构按随访年限及研究资料的
多少收取相应的管理费(100—300元/年/例),保管费用由申办方承担,结题时一次
性付清。
保存到期后,试验归档资料由机构移交给专业组,并做好书面交接记录,专业
组可根据情况自行处理,要求专业组做好处理结果的相应记录。
若保存到期后,申办方委托第三方保存,由机构将试验归档资料移交给申办方,
并做好书面交接记录,保管费由申办方支付。
研究中止及结束
若研究实际完成例数超计划数,按补充协议或按照实际完成情况支付;
若未完成计划例数或已支付金额,可按相应流程办理退款;
若因甲方/申办者原因研究提前中止,需乙方报告伦理会、机构办公室,按照实
际完成情况结算费用,若项目已启动尚未入组但申办者撤销试验,应支付至少2例
受试者的研究观察费。
合同合作期限(视具体情况):
从年月日至年月日,共月,乙方在如下时间范围之内进
行并完成临床试验部分(计划):
开始入选受试者:年月日
结束入选受试者:年月日
结束观察日期:年月日
入组期:个月,观察期:周
完成全部CRF填写:
财务协议(视具体情况)
1.项目伦理费:元。
2.试验例数:____例,每例_________元,明细见列表:
3.资料管理费:_______元;
4.研究牵头费:元;
5.单例研究费用明细:(预计费用,部分完整病例按照实际完成情况支付)
研究者
访视名称
筛选访视
基线访视
治疗**周访视
访视**
随访**周访视
结束访视(*周)
小计:
合计:
6.付款计划(暂按**例计算)
(首付款一般不低于30%-50%。)
付款次数
伦理费
首付款
中期付款
尾款
付费内容/金额/比例
伦理费100%元
付款时间
伦理会后
首例入组前
随访结束
结题盖章前
观察费检验科
实验室检查费
放射科**
其他
年月日
备注:以上为付款计划,末期付款时按照实际完成的有效病例数清算。
7.付款方式:甲方按照以下方式支付给乙方试验费用。付款收到后,乙方负责提
供收费票据。
开户行:工行鞍山分理处
户名:上海交通大学医学院附属新华医院
账号:
成果的归属与分享:
1.试验报告及报告内所包含的试验资料和数据按研究方案的规定办理;
2.乙方如果将试验结果用于科研会议或发表,需事先得到甲方的许可。
违约责任
双方应严格履行合同的约定,因一方违约给他方造成损失应承担赔偿责任。
其他:
1.如因甲方原因提前终止试验,所付款额按终止时已入选的病例数决定;如果由
乙方原因提前终止试验,所付款项金额双方协商解决。
2.以上未尽事宜,由甲乙双方本着互助的诚意协商解决。本协议有争执时,经协
商仍不能达成一致意见的,应根据提交上海仲裁,双方对仲裁机构不能达成一
致意见的,可选择第三地仲裁机构,或者中华人民共和国法律解决。
3.本协议未尽事宜由双方协商妥善解决。
4.本协议一式*份,甲乙方签字后保存。
5.本协议自双方签署之日起生效。
甲方名称:
(盖章):
负责人签字:
签字日期:
乙方名称:
(盖章):
药物临床机构负责人:
上海交通大学医学院
附属新华医院
签字日期:
专业组负责人/主要研究者:
签字日期:
/
/
推荐内容
-
8月19日上海疫情最新实时数据公布 上海昨日新增1例本土确诊病例
说到上海大家都不陌生,一个极其繁荣奢华、令无数人向往生活的大都市,纸醉金迷,灯红酒绿。仿佛进入上海就等同于进入了社会一个更高的...
-
上海各大医院排名及专治各科
-2022年4月21日发(作者:前列腺癌能活多久)综合排名:综合排名比得主要是综合医院,专科医院就不参与了,这当中也包括三甲中医院,因为现在
-
2022年农民补贴政策最新消息 农民超过60岁国家补贴是什么有何要
众所周知,60岁,已经是符合法定退休年龄的规定了,不少人买了15年社保以上,退休后有养老金。那么,对于没买社保的农民,在60岁以后有什么
-
防止细胞壁重塑可能是击败顽固性超级细菌的关键
B multivorans是一种臭名昭着的病原体,可导致免疫功能受损的个体患有肺炎等感染,包括潜在的肺部疾病,包括囊性纤维化。这种病原体还可
-
8月5日武汉疫情最新消息通报 武汉公布新增确诊病例和无症状感染
说起疫情这两个字眼,想必朋友们都是感触良多,老百姓们都投入到抗疫当中,从生活中各方面去完善疫情防控。虽然目前疫情的到了稳定的发展,但
-
南京制定好人法条 预计在下半年实施
近日一则南京制定好人法条的消息引发了网友们的热议,具体是怎么回事,下面一起去看看吧?6月24日,南京市人大常委会第二十三次会议通过《南
-
11月2日哈尔滨疫情最新实时消息公布 哈尔滨65463名应检未检人员
当前疫情防控形势仍然严峻复杂,要紧绷疫情防控常态化这根弦,始终保持警惕、严密防范。从当下全国各地的疫情形势来看,似乎已经迎来了好...
-
13月2日河南疫情最新数据公布 河南昨日新增境外输入无症状感染者1例
温馨提示:一旦出现发热、干咳、乏力、鼻塞、流涕、咽痛、嗅觉味觉减退、结膜炎、肌痛和腹泻等症状,应及时按规范程序就诊,并主动告知1...
-
11月5日河南漯河疫情最新消息公布 漯河召陵区公布一例密切接触者
漯河市,河南省地级市,河南省人民政府批复确定的国家食品名城、区域性交通枢纽城市、中原经济区重要的现代商贸物流中心、生态宜居城市...
-
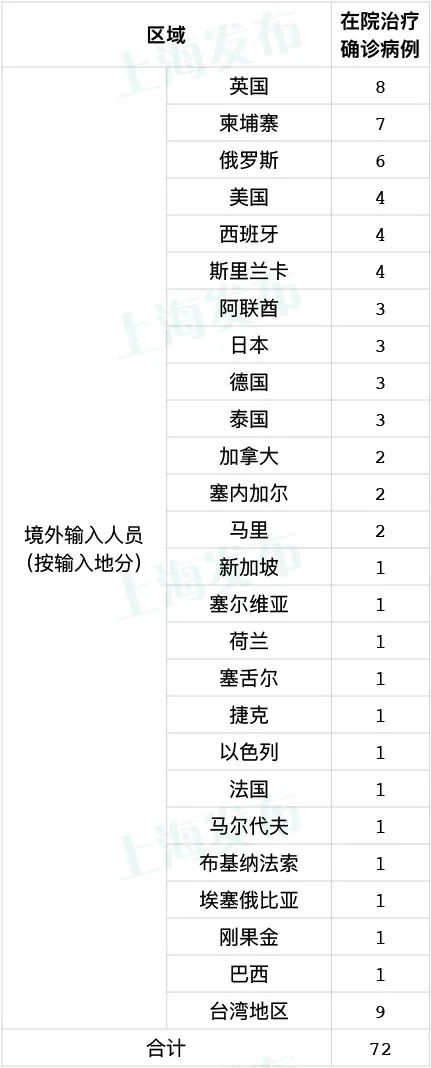
7月14日上海疫情最新数据公布 上海新增5例境外输入病例
上海疫情,上海疫情最新消息,上海疫情最新消息今天,上海疫情最新分布,上海疫情最新消息今天新增,上海疫情最新消息通知。据最新消息显示,上