突破性发展抗病蛋白
X射线和电子显微镜技术有助于展现蛋白质伴侣的故事。
X射线晶体学和低温电子显微镜(cryo-EM)的组合有助于协同努力以获得真菌蛋白质Hsp104的最高分辨率结构,其可用于阻止某些退行性疾病的形成。该团队的成员包括来自美国能源部(DOE)阿贡国家实验室的研究人员,他们也证实了蛋白质形成的六聚体的螺旋结构,曾经被认为是平坦的。结果发表在2018年12月27日的Structure上。
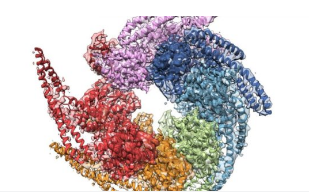
Hsp104是一种六聚体AAA +蛋白质,称为伴侣蛋白,有助于蛋白质的自然折叠过程,从而实现正常的细胞功能。更重要的是,也许这类六聚体可以修复错误折叠或聚集的蛋白质,这些蛋白质可导致蛋白质引起的异常,如神经变性。
这些分子伴侣的变体在多细胞生物中很常见,但Hsp104在人和其他动物中没有同源物。虽然它比人类导出的分子伴侣在细胞应激下更加稳健,但已观察到Hsp104折叠人类蛋白质。
“我们做了一些实验,我们在酵母中表达了人类蛋白质,这使酵母生病,因为它们聚集在一起。但如果你表达真菌Calcispporiella thermophila的 Hsp104 ,它可以保护酵母免受这种聚集疾病的影响,”Argonne Distinguished FellowAndrzej说道。 Joachimiak。
Joachimiak与来自Argonne,芝加哥大学,斯坦福大学和宾夕法尼亚大学的研究人员合作,以更好地了解Hsp104的结构和功能。
该团队求助于Argonne的Advanced Photon Source,一个DOE科学用户设施办公室,使用X射线晶体学探测蛋白质的结构。他们检查了30种不同的样本,包括来自不同来源的14种Hsp104伴侣。在该过程中,将单晶投入液氮中并经受硬X射线,从中收集衍射图案并重建结构。Joachimiak指出,只有来自Calcarisporiella真菌的蛋白质才能衍生出高分辨率。
为了更好地了解蛋白质在活细胞内的结构关系,他们接下来转向研究溶液中的蛋白质。样品在芝加哥大学使用电子显微镜进行筛选,然后送到斯坦福大学,在那里冷冻电子显微镜采集了通过复杂计算确定结构所需的高分辨率分子数据。与晶体研究一样,Calcarisporiella样品提供了最佳分辨率。
现在,无论是晶体形式还是解决方案,Hsp104的分辨率最高,该团队能够对蛋白质的特征和行为做出以前未知或不确定的决定。
在团队发现之前,生物学家认为Hsp104支持五个结构域,即蛋白质的独立部分,它们具有特定的功能。但新的高保真结构不仅揭示了四个领域,而且更清晰地展示了它们如何相互关联。
例如,N末端结构域被认为与错误折叠的蛋白质结合并帮助其展开成线性形式。这允许它通过由两个AAA(与各种细胞活动相关的ATP酶)域产生的六聚体中的狭窄中央通道。蛋白质通过这个通道被引导或移位到六聚体的另一侧,现在它有了一个正确折叠的新机会。
“以前人们声称另一个,即C末端域,对于六聚体的形成至关重要,但我们已经证明这不是真的,”Joachimiak说。“它不与其他亚基相互作用,但可能作为其他分子伴侣的对接区域,帮助重新折叠蛋白质。”
另一个关键的发现帮助扭转了长期以来的观点,即Hsp104的六聚体是扁平的。两种调查方法都明确证明它们是螺旋形的,帮助研究人员了解陪护者如何形成“修复”通道。
该团队计划继续探索人类基因组之外存在的许多不同的伴侣。他们认为这些分子伴侣可以作为一种治疗策略,有可能彻底解开可能导致严重疾病的蛋白质。
“有可能有其他伴侣比我们更好,他们将能够治疗在大脑中聚集并导致疾病的蛋白质,”Joachimiak说。“那真是太棒了。”
推荐内容
-
西安9人赴河北参加婚礼遇新冠病例在场 返程轨迹曝光令人后背发凉
自年初疫情爆发以来,注定了2020年是不平凡的一年。随着疫情的蔓延,今天一则关于西安9人赴河北参加婚礼遇新冠病例在场的消息引起了网友们
-
适当挨饿能使寿命翻倍?北大科研新证实:少吃可改写衰老基因
适当挨饿能使寿命翻倍?北大科研新证实:少吃可改写衰老基因 原标题:适当挨饿能使寿命翻倍?北大科研新证
-
“战争附件”探讨了空间科学与军队之间不安的联盟
深夜喜剧演员在8月份宣布了美国军方新分支空间力量的初步计划时与副总统迈克·彭斯纠缠不定。吉米·金梅尔将这个想法比作迈克尔·海湾动...
-
微生物移植物在危害濒危的夏威夷植物中提供抗病性
根据夏威夷大学Mānoa(UHM)植物学系和奥阿胡军自然资源的修订实验室的新研究,从健康相关植物移植野生微生物可以使夏威夷本土植物更健康,
-
广州出现云墙 云墙是怎么形成的?
云墙是什么?说起云墙想必大家都非常的陌生,因为,云墙是热带风暴、台风水平结构的组成部分,由大量潮湿空气强烈上升而形成的积雨云组成,
-
60岁以上老年人便秘的发病率高达22% 关爱老人 从关注便秘做起
便秘会带来很多问题,例如腹胀、食欲减退、头痛、呕吐、肚子痛、生痔疮等。道家养生有句俗话若得长生,肠中常清,若要不死,肠中无屎。所以
-
间歇性禁食可以改善肥胖女性的健康状况
在阿德莱德大学进行的研究表明,肥胖女性在严格控制饮食的同时间歇性禁食,减轻了体重,改善了健康状况。该研究发表在 肥胖 杂志上,其中
-
10月27日陕西西安市疫情最新消息公布 西安市通报5起涉疫情违法案件
警方提醒:严格遵守疫情防控措施,既是对个人负责,也是对社会和他人负责。希望广大市民群众从自身做起,主动履行防疫责任和社会义务,...
-
10月29日辽宁沈阳疫情最新数据公布 日前沈阳疾控再发紧急健康提醒
想必大家都知道,沈阳,简称沈,古称奉天、盛京,是辽宁省辖地级市、省会、副省级市、特大城市、沈阳都市圈核心城市。那么,你知道沈阳...
-
研究表明人类微生物组代谢物可增强肠出血性大肠杆菌的结肠损伤
为什么人类相对容易被一些细菌或病毒病原体感染,而具有非常相似的组织和免疫功能的动物则不然。这种鸿沟也是研究人员在动物模型(如小鼠...