新基JAK2抑制剂获FDA优先审评资格 治疗骨髓纤维化
3月5日,新基(Celgene)制药公司表示,公司旗下JAK2抑制剂fedratinib用于骨髓纤维化治疗的上市申请获得FDA优先审评认定,预期做出审批决定日期为9月3日。Fedratinib除了治疗骨髓纤维化外,其它在研适应症还有真性红细胞增多症。该药物为Celgene在2018年1月通过并购Impact Biomedicines获得。根据这笔交易,Celgene公司将支付约11亿美元现金,如果fedratinib在骨髓纤维化和其它适应症中获得批准,则Impact Biomedicines公司的股东有资格获得高达14亿美元的额外付款。

Celgene的本次上市申请是基于临床3期研究JAKARTA的数据。结果表明,fedratinib达到了主要及次要研究终点,47%的患者在24周时脾脏体积至少减少了35%,同时36%的患者的症状评分也比安慰剂提高了至少50%。本次上市申请还得到了中期研究JAKARTA-2数据的支持,该研究入组患者为此前接受Jakafi (ruxolitinib)治疗的原发性及继发性骨髓纤维化患者。
Fedratinib在入手Impact Biomedicines之前由赛诺菲进行开发,当时代号为SAR302503,但由于该药物在后期临床试验中的一些患者出现了韦尼克脑病,并且收到了FDA的临床暂停信,使得赛诺菲做出停止开发的决定。在2016年,Impact从赛诺菲获得了fedratinib在全球的开发与商业化权益,赛诺菲没有向Impact收取任何先期付款。FDA也在2017年收回了对该药的临床试验暂停决定。
Celgene首席医学官Jay Backstrom表示:“骨髓纤维化患者,包括接受或治疗失败的患者数仍在继续增加,该疾病具有明确的医疗需求。Fedratinib可以在骨髓纤维化的治疗中发挥重要作用,我们期待在审查过程中与FDA合作。”
Fedratinib此前已经获得治疗原发性或继发性骨髓纤维化的孤儿药资格。Celgene同时计划将该项目与luspatercept联用用于β-地中海贫血及骨髓增生异常综合征的治疗研究。
骨髓纤维化简称髓纤,是一种由于骨髓造血组织中胶原增生,其纤维组织严重地影响造血功能所引起的一种骨髓增生性疾病,原发性髓纤又称“骨髓硬化症”,本病具有不同程度的骨髓纤维组织增生,常见于50~70岁老年人。鲁索替尼(JAK1/2抑制剂)是FDA批准的首个治疗骨髓纤维化的药物,2018年全球销售额达到23.64亿美元。
推荐内容
-
郑爽背后神秘金主曝光引热议 郑爽金主胡广松是谁长什么样多
【 郑爽背后神秘金主曝光 】郑爽为何资源好到爆?背后最大金主终于曝光,难怪娱乐圈无人敢动。而今天的你是否有在关注郑爽背后金主大曝光的这
-
竹篮打水一场空 哈工大2名学生因作弊开除学籍
现如今作弊现象很普遍,不过普遍并不意味着理所当然。作弊既是对自己的不尊重,也是对别人的不尊敬。对其他真正用心付出过的人很不公平...
-
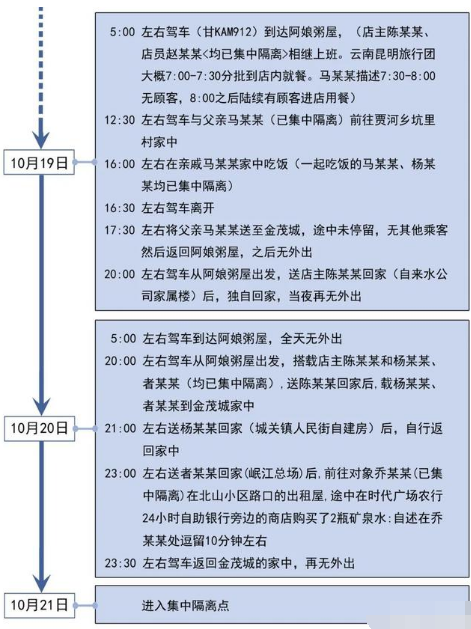
10月27日甘肃陇南疫情最新数据公布 陇南昨日新增1例确诊病例轨
疫情期间,严格注重个人卫生习惯。养成人群聚集和密闭场所佩戴口罩,勤洗手、公筷制、分餐制,咳嗽打喷嚏时注意遮挡等良好卫生习惯。宕...
-
11月1日山东五莲疫情最新数据公布 五莲县昨日新增本土新冠肺炎
山东五莲公布新增本土确诊病例1例详情:为2名感染者的女儿,轨迹涉及学校。那么,对于山东五莲疫情的这个话题,今天的你是否也在关注着?具
-
初步报告表明 新型登革热疫苗比以前的疫苗更安全
武田疫苗的一组研究人员宣布了一项新型疫苗预防登革热感染的第一阶段试验结果。他们在《新英格兰医学杂志》上发表的论文中,概述了他们...
-
10月27日北京疾控疫情最新消息公布 从疫情发生地来返京不主动报
从疫情发生地来返京不主动报告行程将受罚。那么,对于北京疫情的这个话题,今天的你是否也在关注着?具体什么情况?下面跟小编一起来了解...
-
格力电器诉奥克斯专利侵权 奥克斯赔偿格力4000万元
备受关注的格力电器诉奥克斯专利侵权一案,近日终于尘埃落定了。据中国裁判文书网资料显示,广东省高级人民法院于2019年8月30日作出(2018)
-
11月25日柬埔寨疫情最新数据公布 柬埔寨昨日新增报告34例新冠
柬埔寨新增确诊病例数持续走低。据消息显示,连日来,柬埔寨日增新冠肺炎确诊病例维持在两位数,24日报告的新增病例数,创下新一轮新冠...
-
11.6日新疆疫情最新数据消息公布 新疆此次疫情最早传入点是这里
新疆喀什此次疫情最早传入点,很可能是这里。想必这段时间,大家最关注的话题莫过于新疆疫情一事了。针对此问题,小编收集了一些相关的...
-
超薄2-D金属有自己的元素周期表
周期表的新版本展示了二维金属的预测特性,这是一种不起眼的合成材料。在1原子厚的片材中,大多数这些2-D金属在现实世界中尚未见到。因此,