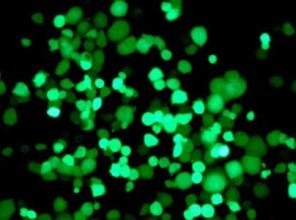
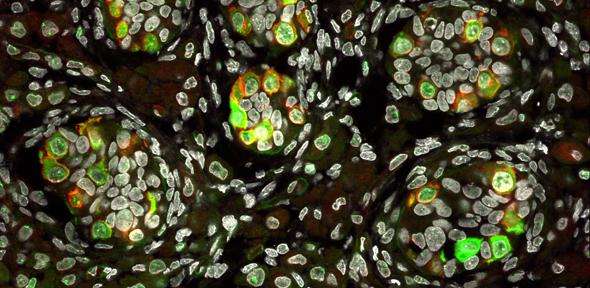
将蛋白质放在适当的位置
许多被称为核RNA结合蛋白(RBPs)的特殊分子,当在细胞核外错位时,会形成多种脑部疾病中出现的有害团块,包括额颞叶痴呆(FTD)和肌萎缩侧索硬化症(ALS)。宾夕法尼亚大学佩雷尔曼医学院生物化学与生物物理学副教授James Shorter博士说:“由这些疾病蛋白形成的团块由粘性原纤维组成,这些原纤维会破坏神经细胞。”“我们希望逆转这些团块的形成,并将RNA结合蛋白放回核心内的适当位置。”
通常,核输入受体(NIR)与RBP上的特定氨基酸序列结合,将它们引入细胞核。由Shorter领导的一个小组在本周的Cell中描述了当他们将NIR添加到由TDP-43和FUS蛋白制成的聚集体时发生的事情,这些聚合物与这些神经退行性疾病有关。
“当我们增加近红外光谱的浓度时,有三个重要且令人惊讶的结果,”共同第一作者林国博士说,他是Target ALS跳板研究员。首先,团块限制性商业惯例的溶解在试管实验。接下来,NIR还溶解细胞中的细胞质团块,并且功能性RBP返回到细胞核。最后,当果蝇疾病模型中NIRs的表达增加时,寿命延长,变性减少。
“所有这些生物化学都是非常出乎意料的,”宾夕法尼亚大学的医学博士/博士生共同首创作者Henry Wang说。“我们没有怀疑NIR会破坏团块,将RBP返回细胞核,并减轻神经变性。”
该团队对NIR能够快速扭转FUS和TDP-43团块形成的速度感到惊讶。从溶解在溶液中的RBP到形成液滴状结构的转变通常在核中作为RBP功能的常规部分发生。然而,当诸如FUS和TDP-43的RBP在细胞质中错位时,这些相变可能变得异常,将RBP设置在破坏性路径上,这可以用NIR校正。但是,NIR表达或活性可能在疾病中减少。
“鉴于这种复杂性,我们正在努力找到一种方法,通过使用蛋白质工程或小分子药物来增加神经元中NIR的表达或活性,共同作者,Shorter实验室的博士生Charlotte Fare说。
推荐内容
-
DNA测序和大数据为寻找新病毒开辟了新的前沿
发现新病毒在历史上一直偏向于表现出疾病症状的人和动物 - 如咳嗽,发烧或皮肤水疱。但是以这种方式发现病毒有两个挑战。首先,它只是识
-
氧化铈纳米颗粒可改善肝细胞癌的预后
肝细胞癌是最常见的肝癌,其死亡率排名世界第三。它的出现与乙型和丙型肝炎病毒,酒精中毒,肝脏的代谢性疾病以及某些毒素的暴露有关。...
-
重新审视废弃的治疗方法 以抗击抗微生物药物的淋病
英国伦敦帝国理工学院的Xavier Didelot本周发表的一项研究表明,之前推荐的治疗淋病的头孢克肟可能是当前治疗方法的有效替代方案,因为临
-
12月13日宁波绍兴杭州三地管控区疫情数据公布 浙江三地新增本
小编在这里提醒大家,疫情期间,尽量做到非必要不出行,如果一定要出行,要关注交通旅游信息,同时还要注意错峰出行,全程做好防护,尽...
-
频繁的珊瑚褪色事件阻止了珊瑚礁完全恢复
据科学海洋科学家团队报道,在全球范围内,珊瑚褪色事件的频率和强度在过去30年中急剧增加。20世纪80年代初标志着对漂白事件进行正式科学观
-
基因编码的Frankenbody点亮了活细胞成像
科罗拉多州立大学和东京工业大学的科学家将互补决定区(CDR)和单链可变片段(scFv)支架拼接在一起,建立了所谓的法兰基体。该杂种产生物可以
-
新证据支持青光眼的遗传基础
一个国际科学家小组分析了遍布五大洲的40,000人的基因组;其中四分之一患有一种眼病,称为青光眼,会导致眼内压力增加。通过筛选青光眼患者
-
在人类DNA中发现了一种古老的逆转录病毒 它可能仍然是活跃的
令人震惊的证据表明,以前只有化石证据才知道的一种古老的病毒已经持续感染了一些非常低水平的人类数十万甚至数百万年。这种古老的逆转...
-
人类和猪胚胎的相似性提供了早期发育阶段的线索
科学家已经证明了卵子和精子细胞的前体 - 这是保护物种的关键细胞 - 是如何通过研究猪胚胎和人类干细胞而在早期胚胎中产生的。在今天发
-
蛋白质的Troika控制叶子老年发病
基础科学研究所(IBS)内的植物老化研究中心的研究人员发现,三个蛋白质中心 - 被称为NAC三驾马车 - 控制着叶子老化的开始。他们的系统研