对速度的需求使基因组编辑有效如果不是更好
莱斯大学的研究人员开发了一种计算模型来量化CRISPR-Cas9蛋白质发现其基因组编辑目标的机制。化学和化学和生物分子工程的Rice教授和校友AlexeyShvets的Anatoly Kolomeisky改编了他们之前开发的系统,以显示蛋白质通常如何找到它们的生物靶标。他们希望修改后的模型能够帮助解开CRISPR的其余奥秘。
在其天然状态下,CRISPR代表“聚集有规律的间隔短回文重复”,是细菌保护自身免受病毒感染的生物学机制。这些细菌包含了一份外国DNA,并建立了所有入侵者的记录。它们在检测到新入侵者时引用该记录并使用它来销毁它们。
近年来,研究人员已开始调整基因组编辑中使用的机制,该机制具有治愈疾病和增强包括人类在内的生物体的潜力。但是,使用CRISPR方法的系统之一CRISPR-Cas9蛋白将切割并替换错误的靶序列,引入突变,这是一个绊脚石。
生物物理杂志中描述的Rice模型发现,当允许这些脱靶编辑发生时,CRISPR-Cas9可能更有效地定位良好的靶标,因为蛋白质不会浪费时间与脱靶相关以继续搜索。
Kolomeisky说,这可能是也可能不是一件好事,但它肯定值得研究。
“错误率(脱靶率)有时是10-20%,”他说。“我们有两个想法:一个是病毒变异非常快,也许细菌试图削减只是稍微突变的目标,以便更灵活。另一个是有蛋白质可以纠正错误,所以如果错误的削减并不多,系统可以容忍它们。
Kolomeisky说,他的模型是一个简单的步骤,可以找出CRISPR编辑的动态。“CRISPR-Cas9是最受欢迎的变种,因为它只含有一种蛋白质,在生物学上更容易使用,”他说。
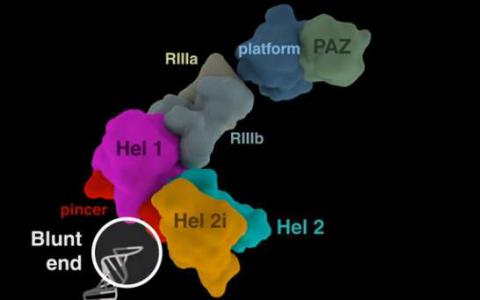
莱斯实验室开发了其原始模型,以了解蛋白质如何沿着DNA滑动以找到目标并触发基因转录等过程。Kolomeisky指出,CRISPR先驱Jennifer Doudna发现CRISPR-Cas9不会以同样的方式寻找。“她发现DNA不会在任何地方滑动,”他说。
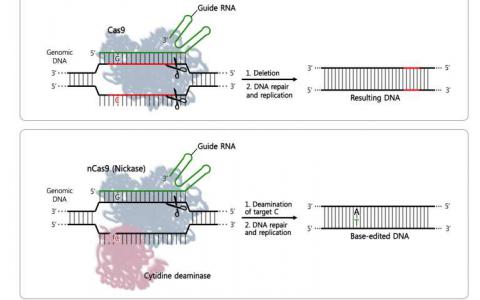
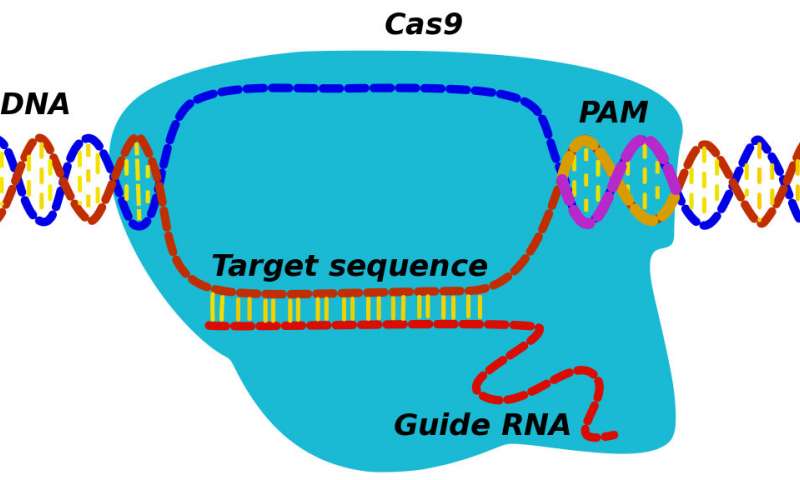
相反,根据Doudna和她的团队,蛋白质最初识别三核苷酸PAM(用于原型间隔相邻基序)序列,标记潜在靶标的位置。“CRISPR发现并结合PAM,然后其相关的RNA探索相邻的DNA,看看它是否是目标,”Kolomeisky说。“如果是的话,蛋白质会开始减少。如果没有,它会解除分离,并寻找其他地方。”
在Doudna随后删除PAM序列的实验中,CRISPR-Cas9蛋白根本找不到它们的靶标。因此,PAMs具有重要作用,而不仅仅是一个通用的间隔物,他说。“一旦我读到这篇文章,我就知道我们也可以在这里使用我们的模型。”
理论模型着眼于第一次通过过程 - 当系统超过物理或化学阈值时发生的那些过程,例如找到相关的PAM来跟踪插入到细胞中的CRISPR-Cas9蛋白,因为它们首先调查PAM序列,然后结合到PAMs,搜索与Cas9 RNA相匹配的DNA靶标。
他们发现,通过与“错误”DNA分离而避免脱靶的切割的CRISPRs比需要切断目标的DNA需要更长时间才能解决。“走向错误的PAM需要时间,”Kolomeisky说。“我们的计算结果表明,当有时会在错误的地方切割时,CRISPR可以更快地找到真正的目标。进入正确目标的部分可能会更小,但最终会削减它们。
“这是一个简单的模型,完全可以解决,”Kolomeisky说。“如果有人想测试,该模型可以提供具体的预测,并在某些情况下提供应该观察的趋势。”模型中遗漏的是能够看到RNA密钥是否同时识别其靶标同时与DNA结合 - 或者依次与核苷酸核苷酸结合。
“关于CRISPR的最令人印象深刻的事情不是在细菌中发现免疫系统,而是在生物技术领域创造了一场革命,因为它意味着在任何细胞中我们都能在特定位置切割任何DNA,非常精确,”科洛梅斯基说。“我希望我们的工作能够激发更多的基础研究,因为我非常喜欢CRISPR方法。但是当人们应用它而不理解它在分子水平上如何工作时,我感到不快乐。”
Shvets现在是麻省理工学院的博士后研究员。Kolomeisky是化学和化学与生物分子工程的教授。
推荐内容
-
满足屠杀病毒的细胞中的小机器
当病毒感染人体细胞时,这些细胞面临着一个难题。他们如何在不伤害自己的情况下销毁病毒呢?犹他州立大学健康科学家通过可视化一个小型细胞
-
具俊晔大S什么时候交往的在一起多久了?大s徐熙媛的前男友都有谁
大S具俊晔结婚两人怎么认识的?具俊晔大s在一起多久了?而对于45岁的女演员大s和52岁的韩团酷龙成员杜俊业宣布再婚的这个话题,今天的你是否
-
10月21日武汉疫情最新数据公布 武汉江夏昨日发现1名甘肃病例密接者
武汉江夏通报发现1名甘肃病例密接者后续:累计检测4681人,结果均显示阴性。据健康湖北微信公众号10月21日消息,10月20日晚,武汉市江夏经
-
Telltale的DNA有助于追踪过去和难以捉摸的野生动物
在炎热的夏日,Mark Stoeckle在纽约East River的阴暗水域扔了一个水桶,装满了三个小塑料瓶。生物学家希望他收集的水包含河流多样化生命
-
使用单分子DNA导航仪解决迷宫问题
智能纳米机器人领域基于具有信息处理能力的分子设备的巨大潜力。在一项支持基于DNA的信息载体趋势的新研究中,科学家们设计了一种DNA导航系
-
利用血缘关系揭示了新的ciliopathy突变
沙特阿拉伯的研究人员发现了54个与ciliopathies有关的基因中的数十个新突变 - 由与& 39;初级纤毛& 39;相关的基因突变引起的综合征,这是
-
FDA批准骨质疏松症注射
美国食品和药物管理局今天批准了Prolia,这是一种注射治疗骨质疏松症的绝经后妇女,这些妇女骨折的风险很高。骨质疏松症是一种使骨骼变弱并
-
近交生物更容易发生肿瘤
根据迪肯大学综合生态中心研究人员的一项综述,近亲繁殖可能导致癌症发病率上升,使人类和濒危动物面临风险。Deakin遗传学专家Beata Ujvar
-
苹果的标志性照片如何激发了改进的细胞分析
在数百万个细胞中识别少量致病细胞是棘手的。苏黎世联邦理工学院的研究人员现已开发出一种技术,能够在小范围内单独和详细地识别大量的...
-
准确的DNA拼写校正方法
基础科学研究所(IBS)的研究人员证明了最近开发的基因编辑方法的准确性。这就像DNA剪刀一样,旨在识别和替代30亿中的一个核苷酸。这是第一次