CRISPR疗法 顶点报告了基因编辑治疗CTX001试验的第一批数据
CRISPR Therapeutics和Vertex Pharmaceuticals今天报道了参与两项I / II期临床试验的前两名患者的初步安全性和有效性初步数据,该数据评估了他们的CRISPR / Cas9基因编辑疗法对两种血液疾病的治疗-这是第一项临床试验由美国公司赞助的基因编辑候选人。

CRISPR疗法首席执行官Samarth Kulkarni博士说:“我们对这些初步数据感到非常鼓舞,这是首次报道了用我们的CRISPR / Cas9编辑的自体造血干细胞候选人CTX001治疗的β地中海贫血和镰状细胞病患者的数据。”在一份声明中。“这些数据支持了我们的信念,即我们的疗法有可能在一次干预后为患者带来有意义的收益。随着我们继续开发CRISPR / Cas9疗法作为治疗严重疾病的新型转化药物,我们将继续招募这些研究。”
Vertex董事长,总裁兼首席执行官Jeffrey Leiden博士补充说:“我们今天宣布的数据非常了不起,并证明CTX001有潜力成为基于CRISPR / Cas9的治愈性基因编辑疗法。”
投资者似乎同意莱顿和库尔卡尼的观点,抢购足够多的CRISPR Therapeutics股票以将其股价在早盘交易中上涨21%,至70.89美元,截至上午10:02时,Vertex的股价几乎没有波动,上涨0.46%(每股97美分) $ 210.97。
九个月的β地中海贫血数据
该公司发布了针对一名输血依赖性β地中海贫血(TDT)患者的九个月数据,该患者于2019年第一季度接受CTX001。该患者在CTX001输注后33天也实现了中性粒细胞植入,在37天后实现了血小板植入。
CRISPR Therapeutics和Vertex报道,在CTX001输注后的9个月时,患者是非输血独立的,总血红蛋白水平为11.9 g / dL,10.1 g / dL胎儿血红蛋白和99.8%F细胞(表达胎儿血红蛋白的红细胞)。
该试验的主要研究者称,该TDT患者经历了两次严重的不良事件-中性粒细胞减少症引起的肺炎和归因于白消安的静脉闭塞性肝病-但均已解决且均与CTX001无关。
TDT试验名为CLIMB-Thal-111(NCT03655678),旨在评估单剂量CTX001在18至35岁TDT患者中的安全性和有效性。该研究将招募多达45名患者,并在输注后随访患者约两年。将要求每位患者参加长期随访研究。美国,加拿大和欧洲的六个临床试验站点正在进行招募。
四个月镰状细胞病数据
CRISPR Therapeutics和Vertex还发布了针对镰状细胞疾病(SCD)患者的四个月安全性和有效性随访数据,该患者于2019年中期接受CTX001。CCD001输注后30天,患有SCD的患者实现了中性粒细胞和血小板的植入。输注CTX001后四个月,患者无VOC,总血红蛋白水平为11.3 g / dL,46.6%的胎儿血红蛋白和94.7%的F细胞(表达胎儿血红蛋白的红细胞)。
在参加该试验并注入CTX001之前,该患者每年经历7次血管闭塞性危机-在同意研究之前的两年中,年均发生率。
SCD患者经历了三种SAE,其中没有一种与CTX001有关:在中性粒细胞减少,胆石症和腹痛的情况下发生败血症。两家公司称,这三个问题均已解决。
SCD试验CLIMB -SCD-121(NCT03745287)旨在评估单剂CTX001对18至35岁患有严重SCD的患者的安全性和有效性。该研究将招募多达45名患者,并在输注后随访患者约两年。将要求每位患者参加长期随访研究。美国,加拿大和欧洲的12个临床试验站点正在进行招募。
CRISPR Therapeutics和Vertex表示,SCD和TDT的临床试验均在进行中,并且有“另外”的患者入选该研究,并补充说,这些患者在输注后将被随访大约两年。
参加研究的患者将从外周血中收集造血干细胞和祖细胞。患者的细胞将使用CRISPR / Cas9编辑。然后,将经过编辑的细胞作为干细胞移植的一部分重新注入患者体内,在此期间患者接受清髓性白硫丹条件治疗。
莱顿补充说:“尽管数据令人兴奋,但我们仍处于该临床计划的早期阶段。” “我们期待在未来的几个月和几年中继续与医生,患者,护理人员和家属合作,为这两种严重疾病提供最佳的治疗方法,并继续加快我们针对其他严重疾病的基因编辑计划如Duchenne肌营养不良(DMD)和1型强直性肌营养不良(DM1)。”
6月,Vertex承诺通过斥资高达11.75亿美元的额外资金来开发CRISPR疗法来治疗两种疾病,以扩大两家公司于2015年10月启动的潜在的25亿美元以上的合作,以开发基于基因疗法的疗法。两家公司签订了独家许可协议,以发现和开发用于DMD和DM1的基因编辑疗法。
推荐内容
-
柑橘绿化病病原菌对昆虫载体具有肠道扭曲作用
导致柑橘绿化病的细菌不仅会摧毁柑橘果园,还会对传播它的昆虫的肠道造成严重破坏。美国农业部农业研究局研究分子生物学家,博伊斯汤普...
-
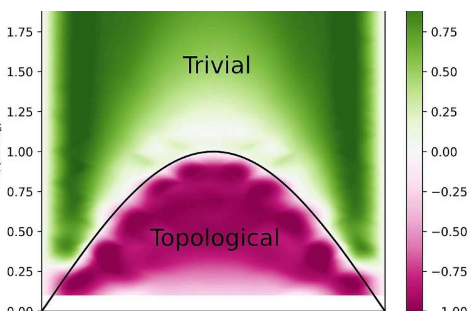
一种从量子材料中提取关键信息的超快速光学方法
拓扑绝缘体是量子材料,由于其奇异的电子结构,其表面和边缘上像金属一样传导电流,同时又可作为整体的绝缘体。Max-Born非线性光学和短脉冲
-
衣原体攻击与弗兰肯斯坦蛋白质
当沙眼衣原体(一种引起全球最常见的性传播感染的细菌)感染人体细胞时,它会劫持部分宿主,在自身周围形成保护层。在这个临时堡垒内,虫...
-
DNA测序和大数据为寻找新病毒开辟了新的前沿
发现新病毒在历史上一直偏向于表现出疾病症状的人和动物 - 如咳嗽,发烧或皮肤水疱。但是以这种方式发现病毒有两个挑战。首先,它只是识
-
重新编程细胞以控制感染
自然控制HIV感染的罕见个体的细胞近15年来一直是研究的焦点,旨在阐明其特定的特征。在对ANRS CO21 CODEX和CO6 PRIMO队列进行研究后,巴
-
科学家发现基因控制基因重组率
遗传学是一个废话。在有性繁殖期间,来自母亲和父亲的基因混合并混合以产生每个后代独特的遗传组合。在大多数情况下,染色体排列正确并...
-
DNA修复快照
DNA就像身体的计算机代码,必须保留它才能让我们的身体生存。然而,随着细胞的生长和变化,DNA很容易出现缺陷,特别是双链断裂(DSBs)。事实
-
抗生素如何传播抗药性
通过从环境中获取抗性基因,细菌可能对抗生素变得不敏感。不幸的是,对于患者来说,抗生素引起的应激反应激活了微生物的能力,能够吸收...
-
发现新的干细胞途径表明玉米 主要作物的产量高得多
冷泉港实验室(CSHL)的生物学家发现了一个重要的发现,有助于解释植物如何调节干细胞的增殖。这一发现对提高玉米和许多其他主要作物的产量具
-
有机耕作方法有利于传粉媒介
传粉昆虫在全球范围内处于危险之中,在过去的40年中尤其急剧下降。瑞典隆德大学进行的一项为期3年的广泛研究发现,有机耕作方法有助于阻止