在CRISPR基因组编辑中 Cpf1证明了其显着的特异性并产生了突变小鼠
作为CRISPR基因组编辑的新工具,Cpf1因其与Cas9不同的属性引起了人们的兴趣:它只需要一个RNA,即CRISPR RNA组装更简单; 其交错的切割模式可以促进用所需的序列取代现有的DNA; 它识别富含胸苷的DNA序列,与Cas9识别的富含鸟苷的序列相比,它的研究较少。总之,Cpf1有望扩大CRISPR基因组编辑目标位点的范围,提高效率。尽管Cpf1作为一种强大的基因组编辑工具具有巨大的潜力,但很少有人证明新工具如何找到其目标。在6月6日在线发表在Nature Biotechnology上的一系列论文中,韩国IBS基因组编辑中心的研究人员将Cpf1作为一种高度特异性的可编程工具,适用于精确基因组编辑,并报告使用CRISPR-Cpf1生成突变小鼠。

研究人员使用了两种类型的Cpf1家族蛋白(AsCpf1和LbCpf),因为它们是同类中最有效的,并进行了Digenome-seq:他们设计的一项测试,用于识别预期(目标)和非预期(脱靶)位点。研究人员希望Cpf1在整个基因组中进行切割。从预先组装的重组Cpf1 RNP切割从人细胞分离的无细胞基因组DNA,并进行全基因组测序。通过计算鉴定对应于靶标和脱靶体外切割位点的序列读数的均一比对。
全基因组分析表明,与Cas9相比,Cpf1具有高度特异性,显示出较少的脱靶切割位点(LbCpf1为6,AsCpf1为12),在人类基因组中> 90个位点切割(图1a)。具体而言,在大多数体外切割位点,indel(代表脱靶效应)低于0.1%,远低于相应的靶标位点,表明两种Cpf1蛋白几乎没有脱靶效应。“值得注意的是,针对特定位点的LbCpf1和AsCpf1仅切割整个人类基因组中的靶标位点”,该研究的第一作者之一KIM Daesik说(图1b)。
“为了减少脱靶效应,我们将预装配的Cpf1 RNP引入细胞,假设Cpf1 RNP与Cas9 RNP类似,在转染后立即切割靶位点,并会被破坏蛋白质的内源酶快速降解,从而减少 - 在不牺牲目标效应的情况下实现目标效果。“ KIM Jin-Soo说,两篇论文的通讯作者和IBS中心主任。实际上,Cpf1 RNPs没有诱导任何足够高的插入缺失以在非靶位点产生突变(图2)。
显示Cpf1显着的特异性,来自同一IBS中心的另一个研究小组成功地将Cpf1 RNP介导的突变引入小鼠胚胎:研究人员针对Foxn1(调节免疫系统的转录因子,包括皮肤毛发的生长),以及酪氨酸酶(一种催化黑色素生成的酶,黑色素是一种决定皮肤颜色的天然色素)。该研究的第一作者HUR K Junho说:“数据显示Cpf1 RNP向小鼠胚胎的分娩导致了高突变频率的预期遗传功能,分别为64%和33%。我们将突变小鼠胚胎移植到替代品中母亲和获得有针对性突变的小鼠。突变分别导致无毛和白发小鼠(图3a)。赫尔补充道,“ 为了研究Cpf1是否具有脱靶效应,我们使用从一个Foxn1突变小鼠及其野生型同胞中分离的基因组DNA进行全基因组测序。序列分析显示没有发生脱靶突变。其他突变体的靶向深度测序也显示没有脱靶突变“
在这项研究中,研究人员使用电脉冲将Cpf1 RNP 同时渗透到多达50个小鼠胚胎中(图3b)。这种新的电穿孔提供了用于产生突变动物的基因组编辑分子。与常规显微注射相比,电穿孔方法易于实施,快速且可扩展。
将Cpf1添加到其工具箱中,CRISPR编辑技术可以构建更多样化的鼠标模型。IBS基因组编辑中心主任兼两位研究的相应作者KIM Jin-soo评论说:“由于这两项研究证明了Cpf1的优越特异性,这种新的核酸酶将被更广泛地用于精确的基因组编辑,而不是CRISPR Cpf1的应用不会受到限制,但仍然保持开放,从治疗性治疗开始,如无毒性癌症药物,干细胞治疗,高附加值牲畜和农产品。“
推荐内容
-
减肥吃水果?你了解多少
面对流言,希望我们第一时间想到的是寻找官方回应。而不是着急着把流言传播出去,毕竟现在网络相关的法律法规都出台了,网络上传播谣言...
-
心理知识:保护心理健康的妙招_保护心理健康有何妙招
现在的人们越来越物质化了,什么都要攀比,其实生活是自己的,过得开不开心只有自己知道。有时候我们真的不需要在意别人的眼光,做自己...
-
上海核酸采样总体平稳有序
上海市5日召开新闻发布会介绍疫情防控最新情况。上海市政府副秘书长、市疫情防控工作领导小组办公室主任顾洪辉介绍,在中央和兄弟省市...
-
方便面32小时内都无法消化?一起来看
互联网时代,每个人都是信息传播者,但是我们必须清楚一点:在没有获得真正证实的消息之前,千万不能随意散播谣言,很容易造成以讹传讹...
-
老年“养生大军”队伍壮大 按摩仪有望升级智能“新宠”
【关键词】血压计、体温计、血糖仪、按摩仪器、保健品 第七次人口普查数据显示,我国人口老龄化程度进一步加深,65岁及以上人口
-
1月11日浙江疫情最新数据公布 浙江昨日新增境外输入确诊病例7例
浙江1月10日新增境外输入确诊病例7例、无症状感染者3例。据浙江卫健委,1月10日0-24时,浙江省新增确诊病例7例(其中之前境外输入的无症状感
-
吃榴莲的时候不能喝酒,还会和这些食物相克?很多人想问
当我们不知道一件事真假的时候,不防多等等官方的回应。因为信息碎片化,很多小伙伴现在上网很容易只看到事情的一面就下定论,其实很多...
-
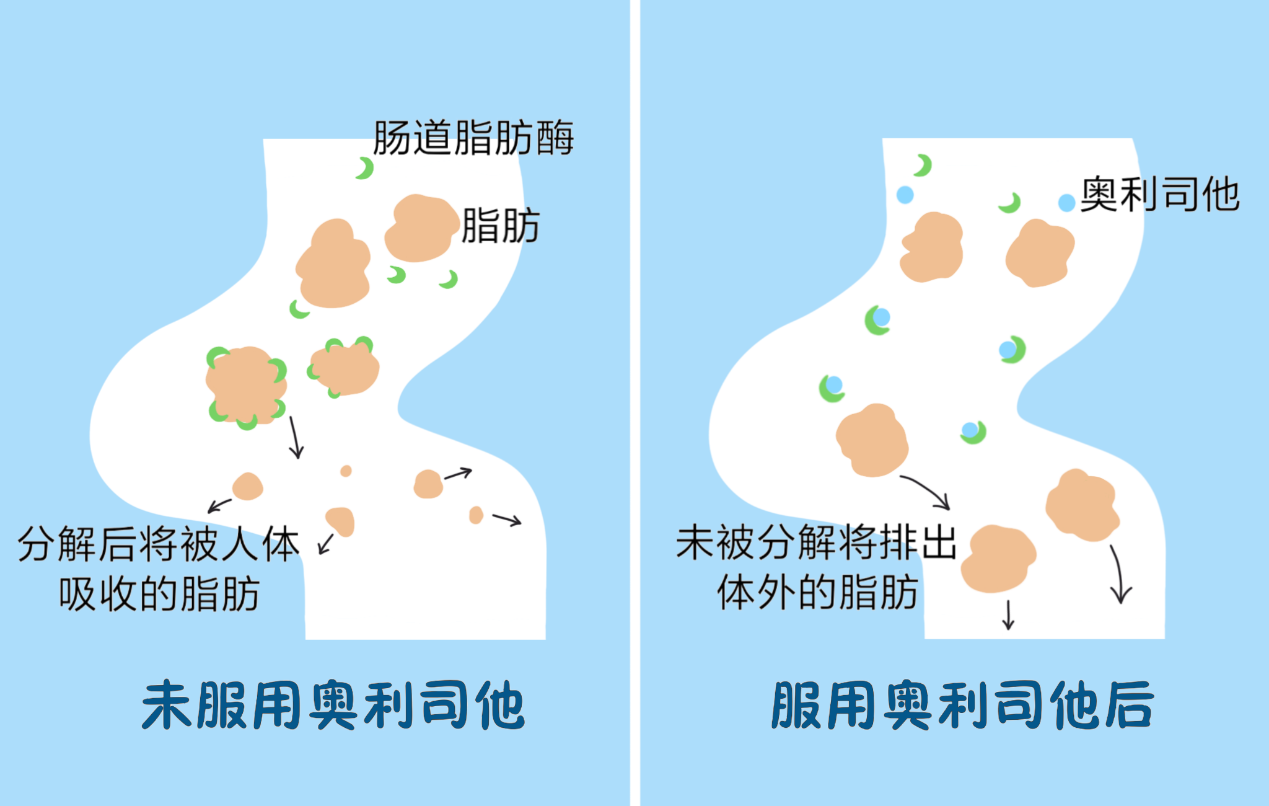
减肥神器--奥利司他真的有效吗?来听听专业人士怎么说
当我们不知道一件事真假的时候,不防多等等官方的回应。因为信息碎片化,很多小伙伴现在上网很容易只看到事情的一面就下定论,其实很多...
-
对酸敏感的分子变化有助于大流行性流感的出现
圣裘德儿童研究医院的科学家确定了血凝素蛋白的分子特性,该分子特性促成了2009年H1N1大流行性流感病毒的出现。这些发现可能有助于官员识别
-
肺癌筛查的扫描可以检测其他与吸烟有关的疾病
肺癌筛查已被美国医学界广泛认可为通过在较早,更易治疗的阶段检测肺癌来挽救生命的有效方法。国家犹太健康研究所的一项新研究表明,肺...