药渡数据库:2018年10月全球批准新药概况
2018年10月,全球首次新批药物主要集中在美国。美国食品药品监督管理局FDA共批准3个新分子实体药物(NME),分别是治疗痤疮的Sarecycline、治疗社区获得性细菌性肺炎(CABP)和急性细菌性皮肤和皮肤结构感染(ABSSSI)的Omadacycline、治疗BRCA突变且HER-2阴性转移性乳腺癌的Talazoparib。FDA首批1个生物制品,即治疗腺苷脱氨酶缺乏症(ADA-SCID)的Elapegademase。
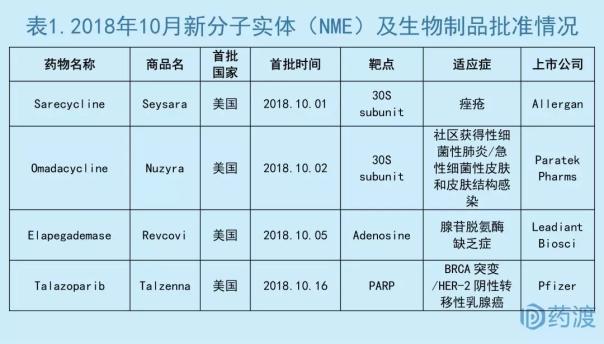
数据来源:药渡数据库
1.Sarecycline
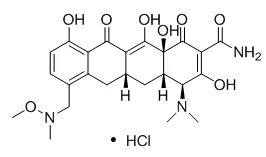
Sarecycline于2018年10月1日获得FDA批准上市,用于治疗寻常痤疮,商品名为Seysara®。该药最初由Paratek研发,之后Allergan获得了在美国的研发及市场化授权[1]。
痤疮是一种普通的皮肤炎症,常见于青少年及部分成年人。约有90%的青少年会出现部分症状,并有半数会持续到成年阶段。而在40岁左右的美国成年人中,仍有1%的男性和5%的女性出现痤疮,给个人生活质量造成一定的影响[2]。除了遗传、激素等病因外,痤疮杆菌(革兰氏阳性菌)与痤疮的发生也有着密切的关系。临床常见的治疗药物包括维生素A、激素和抗生素等[3]。
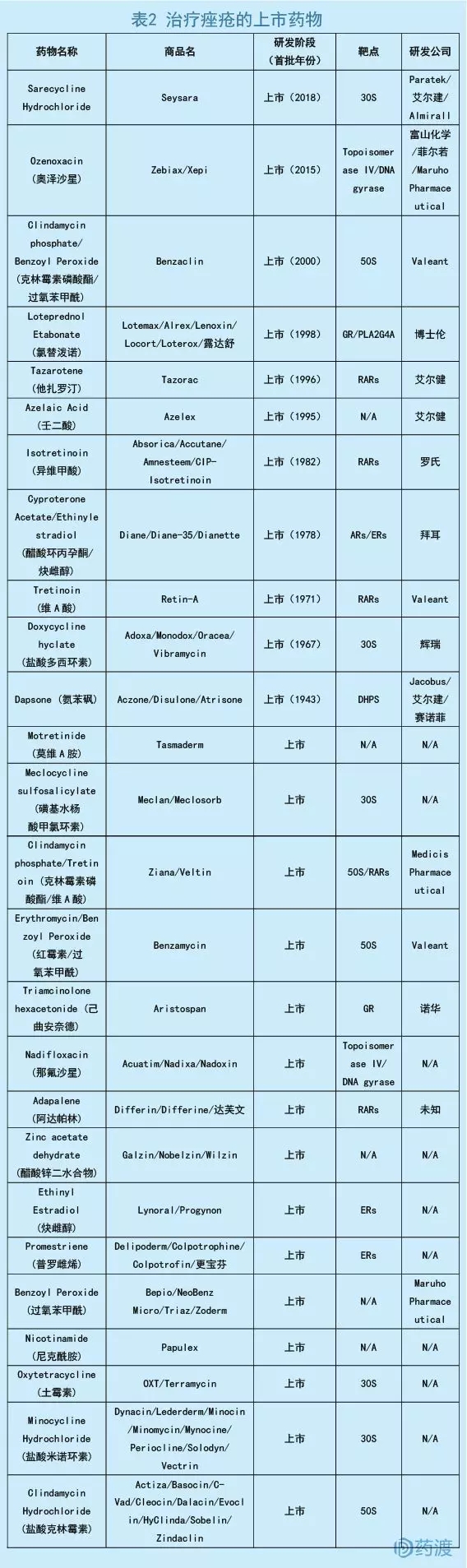
数据来源:药渡数据库
Sarecycline是一种四环素类窄谱抗生素,对革兰氏阳性菌具有较强的抑制作用。Sarecycline通过结合30S核糖体亚基,抑制细菌蛋白质合成[4, 5]。
Sarecycline的获批是基于两项为期12周的多中心、随机、双盲、安慰剂对照的临床三期试验(Trial1:NCT02320149;Trial2:NCT02322866)。主要疗效性终点为研究者总体评估(IGA)、平均炎症缓解率。Trial 1结果显示,治疗组的IGA评估显著优于安慰剂(21.9%,10.5%,p﹤0.0001)。Trial 2结果显示,治疗组的IGA评估显著优于安慰剂(22.6%,15.3%,p=0.0038)。两项试验的炎症缓解率分别达到52.2%和50.8%,均显著高于对照组的35.2%和36.4%(p﹤0.0001)[5, 6]。
四环素类抗生素是治疗痤疮的常见推荐药物,与以往的广谱四环素相比,Sarecycline提升了专性杀菌的能力,上市后将为痤疮治疗提供新的替补用药选择。
2.Omadacycline
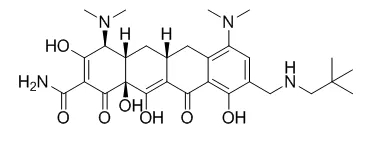
Omadacycline由Paratek研发,于2018年10月2日获得FDA优先评审上市,商品名为Nuzyra®,用于治疗社区获得性细菌性肺炎(CABP)和急性细菌性皮肤和皮肤结构感染(ABSSSI)[7]。近期,欧盟EMA已经受理了Omadacycline的MAA申请,并预计2019年下半年给出评审结果[8]。再鼎医药也于2017年获得了该药在中国的开发及商业化授权。
据美国疾控中心估计,每年美国约有200万人受到耐药性微生物感染,并导致2.3万人死亡。其中,CABP每年引起120万人感染和7000人死亡,而ABSSSI则导致75万例住院[9]。CABP通常由易感微生物引起,如肺炎双球菌、金黄色葡萄球菌(甲氧西林敏感株)、流血嗜血杆菌、副流感嗜血杆菌、肺炎克雷伯氏菌、嗜肺军团杆菌、肺炎支原体、肺炎嗜衣原体。ABSSSI主要由金黄色葡萄球菌(甲氧西林敏感株及耐受株)、路邓葡萄球菌、酿脓链球菌、咽峡炎链球菌、粪肠球菌、阴沟肠杆菌、肺炎克雷伯氏菌等引起[10]。
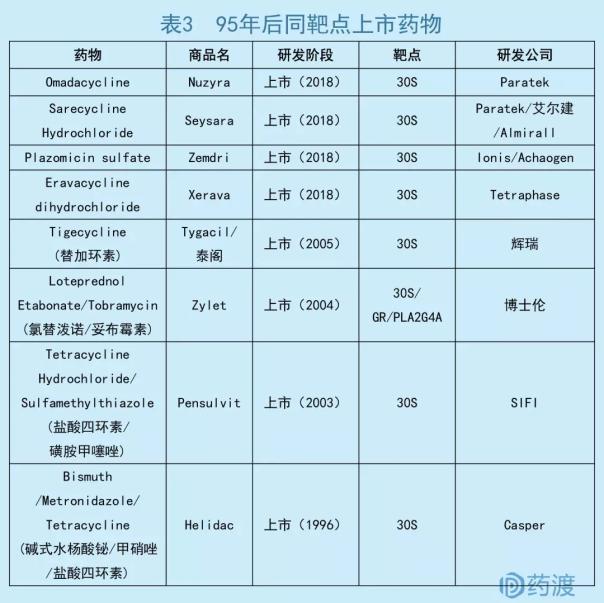
数据来源:药渡数据库
Omadacycline属于四环素类抗生素,通过结合30S核糖体亚基,阻断细菌蛋白质合成。
在一项针对CABP患者的国际多中心、双盲、双模拟临床三期试验中(NCT02531438),试验组和莫西沙星对照组的意向治疗人群(ITT)的早期临床反应率(ECR)分别为81.1%、82.7%;研究者总体评估分别为87.6%、85.1%。Omadacycline的以上疗效终点均不劣于莫西沙星。在针对ABSSSI的两项国际多中心、双盲、双模拟临床三期试验(NCT02378480、NCT02877927)中,试验组的改良意向人群(mITT)的ECR分别达到84.8%、87.3%;研究者评估为86.1%、83.9%。两项终点均不劣于利奈唑胺对照组的ECR(85.5%、82.2%)及研究者评估(83.6%、80.5%)[10]。
随着抗生素的滥用,细菌耐药性已经成为当今的世界性难题。Omadacycline是通过对米诺环素化学修饰得到的半合成化合物。除了研发新的药物结构外,从上市老药中进行探索也是一种思路。
3.Elapegademase
Elapegademase由Leadiant Biosciences研发,于2018年10月5日获FDA批准上市,商品名为Revcovi®,用于治疗腺苷脱氨酶缺乏症(ADA-SCID)。早在2015年,该产品就被美国FDA认证为治疗ADA-SCID的孤儿药[11]。
ADA-SCID是一种罕见的遗传性疾病,多见于婴幼儿,以腺苷脱氨酶缺乏为特征。ADA参与嘌呤代谢,催化腺苷或脱氧腺苷可逆水解为肌苷或脱氧肌苷,以及产生几种正常的甲基化腺苷。低水平的2’-脱氧腺苷或腺苷对于维持正常免疫细胞数量和降低机会感染至关重要。而由ADA缺乏导致的腺苷升高,会诱发淋巴细胞的凋亡并阻止其分化,造成T-淋巴细胞减少[12]。
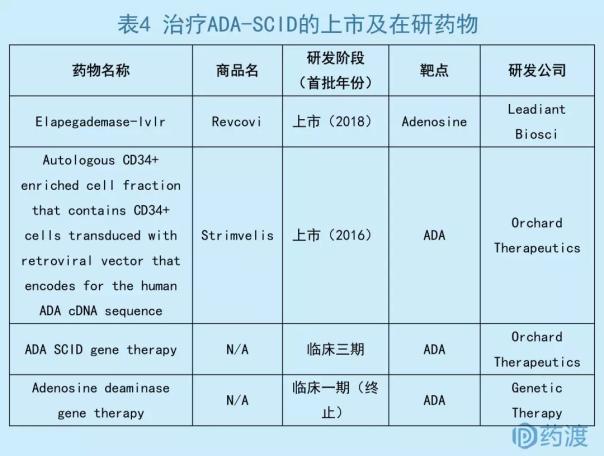
数据来源:药渡数据库
Elapegademase是一种重组腺苷脱氨酶,以牛的ADA氨基酸序列为模板,通过转染大肠杆菌E.coli制备,并偶联聚乙二醇形成。该药物可以向患者提供ADA酶,降低腺苷及脱氧腺苷的毒性累积。
Elapegademase的获批是基于在美国开展的一项公开标签、多中心、单臂、单向交叉的临床三期试验(NCT 01420627),以及另一项在日本完成的单臂临床试验。3个主要指标dAXP(脱氧腺苷核苷酸浓度)、血浆ADA活性、免疫状态(淋巴细胞及亚型数目、免疫球蛋白数量)均达到了疗效终点[12]。
继基因疗法制品Strimvelis®上市后,Elapegademase成为全球第2个应用于ADA-SCID的上市药物。与价格高昂的Strimvelis®和稀缺的骨髓移植相比,重组生物酶更具有市场前景和临床普及意义。
4.Talazoparib
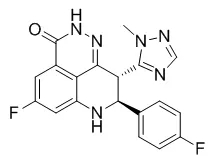
Talazoparib最初由LEAD Therapeutics(2010年被BioMarin收购)研发。2015年8月,Medivation公司从BioMarin获得了该药的研发及商业化授权。2016年8月辉瑞收购Medivation之后,对Talazoparib进行继续开发,并于2018年10月16日获FDA优先评审上市,用于治疗BRCA突变/HER-2阴性转移性乳腺癌,商品名为Talzenna®[13]。
乳腺癌是女性最常见的肿瘤疾病,全球每年约150万位女性被诊断出乳腺癌。2015年,全世界约57万女性死于乳腺癌,占女性癌症死亡的15%[14]。BRCA1/2是遗传性乳腺癌的易感基因,致病突变基因携带者患乳腺癌的风险高达72%(BRCA1)、69%(BRCA2)[15]。
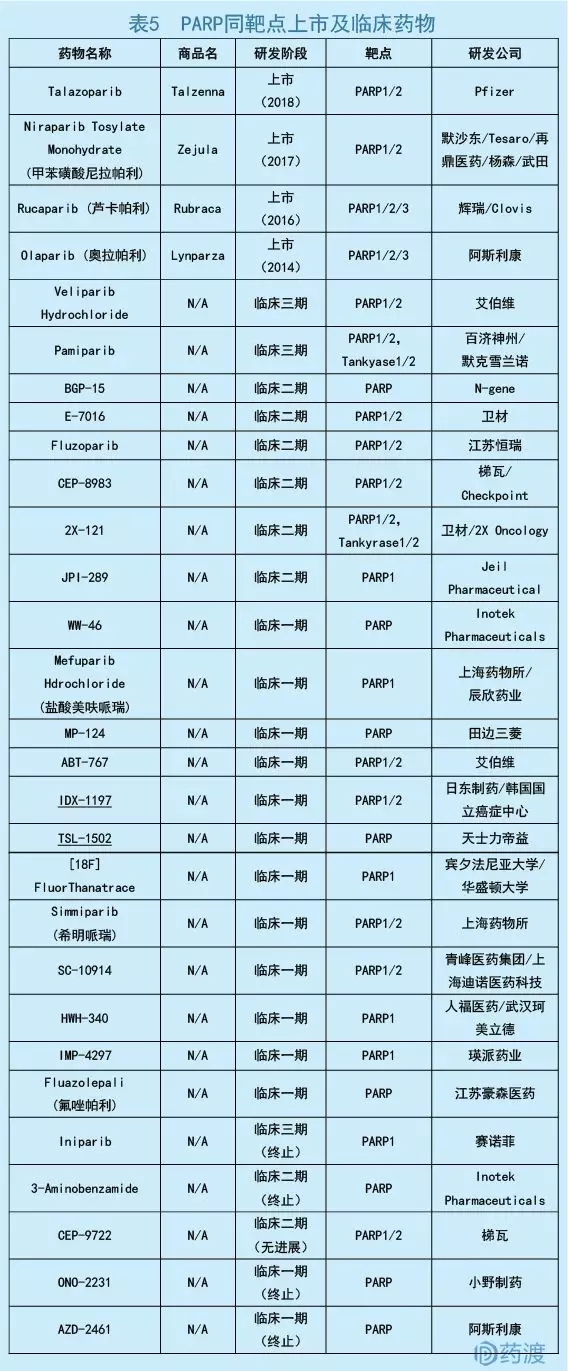
数据来源:药渡数据库
正常的BRCA属于抑癌基因家族,其产物通过同源重组修复DNA双链,防止DNA损伤累积而造成的细胞癌变。突变型BRCA蛋白(如胚系突变gBRCAm)无法修复DNA损伤,细胞启动PARP酶进行单链修复。然而,gBRCAm细胞对PARP抑制剂十分敏感,当两条修复路径被阻断后,癌细胞发生凋亡,即合成致死效应[16]。Talazoparib是DNA修复酶PARP(包括PARP1/2)的抑制剂,通过抑制PARP酶活性,增加PARP-DNA复合物的形成,最终降低癌细胞的增殖能力并促使凋亡。
Talazoparib的获批是基于一项开放标签的临床三期试验(NCT01945775),主要研究终点为无进展生存期(PFS)。Talazoparib组与标准单药化疗组(卡培他滨、艾日布林、吉西他滨或长春瑞滨)的中位PFS分别为8.6个月和5.6个月(HR=0.542,p<0.0001),具有显著性差异[17]。
Talazoparib是FDA批准的第4个PARP抑制剂。目前,该领域基本由阿斯利康(Olaparib)、Clovis (Rucaparib)、Tesaro (Niraparib)和辉瑞(Talazoparib)领跑。作为首个PARP抑制剂药物,Olaparib先后在卵巢癌和乳腺癌领域获批,并从卵巢癌四线药物走向一线。通过辉瑞授权,Clovis历时5年实现了Rucaparib在卵巢癌领域上市。而Tesaro从默沙东授权的Niraparib以治疗卵巢癌二线药物上市,并成为Olaparib强有力的竞争对手。相比跨国药企,国内项目尚处于临床阶段。Talazoparib的顺利获批,将继续推动该领域的竞争。
推荐内容
-
8月19日英国疫情最新实时数据公布 英国昨日新增确诊33904例
你知道英国疫情目前什么情况吗?英国疫情严重吗?据消息显示,英国新增确诊33904例,英政府正在考虑9月为最弱势人群接种加强针。当地时间8月1
-
杨超越耍大牌言论引争议 杨超越工作室声明杨超越回应耍大牌事件
今日杨超越之前在某个节目的采访中疑似回应耍大牌的视频被再度翻出讨论,引发网友热议和关注,在今天下午,杨超越也是发博回应了此事,...
-
研究人员报告说房主院子里的非本地植物会危害野生动物
人类主导的景观是地球上发展最快,最不了解的生态系统之一。历史上,在城市地区,土地所有者将原生植物群落转变为以非本地物种为主的栖...
-
8月14日江苏扬州疫情最新实时数据消息公布 江苏扬州昨日新增本
国内疫情控制得很好,风险度是逐渐下降,但个别地方还是会有零散的病例发生。据最新消息显示,江苏8月13日新增本土确诊18例,均为扬州报告。8
-
上饶疫情解封预计还要多久?上饶疫情大概什么时候解封
提醒:疫情期间,请牢记新冠肺炎十大症状:发热(体温≥37 3℃)、干咳、乏力、嗅觉和味觉减退、鼻塞、流涕、咽痛、结膜炎、肌痛、腹泻...
-
2022年个税专项扣除什么时候填报?2022年个税具体申请步骤流程
众所周知,每个中国公民都有义务纳税,正所谓依法纳税光荣,偷税漏税可耻。那么,你知道2022年个税专项扣除填报时间在什么时候吗?下面跟小
-
国务院鼓励各地增加号牌指标投放 具体发布了什么措施?
11月18日,国务院常务会议指出,今年疫情严重影响消费,恢复正常增长存在不少困难。按照党中央、国务院部署,实施扩大内需战略,进一步促进
-
河南双汇事件是真的吗始末介绍 万隆集团是干什么的总资产有多少?
想必大家今日最关注的事情就是万洪建举报父亲万隆偷税漏税一事了,王洪建还爆料万洲国际的作用是把双汇的钱转移到境外。那么,事实真相...
-
11月11日上海进博会疫情最新消息公布 第四届进博会疫情防控实
温馨提示:尚未接种新冠病毒疫苗的群众(有接种禁忌症除外),请尽快持本人身份证到附近的接种点完成疫苗接种。继续加强个人防护意识,养...
-
8月10日北京疫情最新数据公布 北京昨日新增1例境外输入无症状感染者
小编在这里提醒大家,疫情期间,严格落实就医制度。如出现发热、咳嗽、胸闷气促等症状,请佩戴口罩到定点医院发热门诊就诊,不要到普通...









