黑猩猩寄生虫物种的基因组揭示了人类疟疾的进化
了解新发疾病的起源 - 以及更成熟的疾病因素 - 对于衡量未来人类感染风险并寻找新的治疗和预防方法至关重要。这适用于疟疾,每年导致超过50万人死亡。症状包括严重贫血,妊娠相关疟疾和脑型疟疾,与寄生虫引起感染的红细胞与血管内层结合的能力有关。

由Beatrice Hahn博士领导的国际团队,宾夕法尼亚大学Perelman医学院医学和微生物学教授,以及MD / PhD学生Sesh Sundararaman,使用选择性扩增技术对两种不同的疟原虫物种的基因组进行测序,疟原虫(Plasmodium reichenowi)和疟原虫(Plasmodium gaboni),来自极小体积的黑猩猩血液,以找到恶性疟原虫(Plasmodium falciparum)的进化和致病性的线索,恶性疟原虫是影响人类的最致命的疟疾寄生虫。他们的研究结果本周出现在Nature Communications上。
非洲猿类至少有六种疟原虫物种被分类为一个单独的亚属,称为Laverania。其中三种Laverania物种,包括疟原虫(Plasmodium reichenowi)和疟原虫(Plasmodium gaboni),栖息在黑猩猩中,而另外三种,包括产生恶性疟原虫(Plasmodium falciparum)的恶性疟原虫(Plasmodium praefalciparum),存在于大猩猩中。恶性疟原虫的大猩猩起源几年前由同一个国际研究小组发现。
“我们想知道为什么恶性疟原虫如此致命,”哈恩说。“答案必须在蓝图 - 黑猩猩和大猩猩表兄弟的基因组中。我们也想知道恶性疟原虫的大猩猩前体如何以及何时跳入人类,以及为什么这只发生一次。”
感染人类和巨猿的寄生虫共享基因,使其能够隐藏宿主的免疫系统,粘附于组织并引发疾病。更好地了解人类疟疾毒力的演变为药物和疫苗提供了潜在的新目标。
共同作者,宾夕法尼亚大学生物学教授Dustin Brisson博士最初开发了选择性扩增方法来测序细菌基因组。Sundararaman呼吁将这种新方法应用于疟疾研究“是该论文最重要的贡献之一。” 利用这种技术,该团队能够通过在常规健康筛查期间使用从生活在庇护所的黑猩猩收集的少量未加工的血液来生成高质量的Laverania基因组序列。
黑猩猩寄生虫基因组包含有关感染人类的疟疾寄生虫的进化起源的信息的金矿。从全基因组分析中得出的第一件事是寄生虫确实代表了不同的非杂交物种。
此外,每种黑猩猩寄生虫物种的成员显示出比人寄生虫多10倍的遗传多样性。“黑猩猩寄生虫确实突显了恶性疟原虫缺乏多样性,”共同作者保罗夏普博士说,他是爱丁堡大学的进化生物学家,也是哈恩团队的长期合作者。“这很可能是因为这些寄生虫在第一次传播给人类时经历了严重的瓶颈,可能是在过去的一万年内。”
通过比较不同的寄生虫基因组,该团队还发现了一个多基因家族的扩展,该家族控制红细胞重塑,因此有助于寄生虫逃避宿主免疫细胞以及脾脏清除。“改造过程是人类恶性疟原虫感染严重疟疾病理学的关键部分,”共同作者,威尔康信托桑格研究所的疟疾研究员,研究团队的长期成员Julian Rayner博士解释说。“该基因家族从所有其他疟原虫寄生虫中的单个基因扩展到Laverania中的多达21个基因 表明重塑在这组灵长类动物寄生虫的辐射早期进化,不仅有助于它们独特的生物学,而且也有助于它们的成功扩张。“
“我们还发现了基因组的一个短区域,包括两个基本的入侵基因,其中恶性疟原虫与其近亲的差异远远超出我们的预期,”爱丁堡大学博士后研究员Lindsey Plenderleith博士说。与Sundararaman一起比较和注释各种寄生虫基因组。进一步的分析得出了令人惊讶的发现,即这个DNA片段从一个物种水平转移到另一个物种 - 进入恶性疟原虫的大猩猩祖先。
哈恩补充说:“很有可能推测这种不寻常的事件会使恶性疟原虫的前体倾向于使人类定居。” “然而,这种基因转移显然不是整个故事。”
虽然恶性疟原虫的起源现在已经从该组过去的研究中得到了很好的证实,但对于导致其出现的情况一无所知。“从少量未加工的猿血中哄骗整个寄生虫基因组序列将有助于我们更好地了解发生的事情以及是否会再次发生,”Sundararaman说。
“这是研究疟原虫物种的一个激动人心的时刻,因为难以获得足够数量的DNA用于全基因组测序,因此无法培养并因此被忽视,”哈恩说。作为下一步,该团队计划使用现已验证的选择性基因组扩增技术对额外的猿寄生虫基因组进行测序,以确定特定宿主的相互作用和传播要求,从而揭示可用于对抗人类疟疾的脆弱性。
来自位于俄勒冈州波特兰的IDA-Africa的Sanaga-Yong Chimpanzee救援中心和法国蒙彼利埃的研究所(IRD)的同事也是共同作者。
推荐内容
-
8月3日江苏疫情最新数据公布 江苏昨日新增45例本土确诊,其中南
温馨提示:一旦出现发热、干咳、乏力等症状,应立即到就近的发热门诊就诊,并主动告知14天活动轨迹及接触史。就医途中全程佩戴口罩,尽...
-
2021江苏什么时候入梅出梅 附江苏2021入梅出梅时间表
淅淅沥沥的小鱼虽然衬的江南小镇有别样的风景,但是闷热潮湿让人心生烦躁。那么,对于江苏的入梅时间,你知道吗?2021江苏入梅出梅一、2021
-
胚胎图案系统揭示细胞协调以创建令人惊讶的精确模式
当胚胎从一小部分原始细胞发育而来时,它将自身形成精确的空间组织区域和组织。这要求个体细胞通过释放和检测特异性信号分子而在长距离...
-
2021卫生纸涨价最新消息 今年卫生纸要涨价是真的吗?
2021卫生纸涨价是真的吗?纸价上涨有价无市是什么情况?据消息显示,刚刚就有一则关于2021卫生纸涨价的消息引起了网友们的关注。究竟怎么回事
-
个人所得税扣缴系统在哪里怎么操作?个税为什么必须按实际工资申
今天小编为大家带来一则关于个人所得税扣缴系统在哪里的相关文章。如果您喜欢这篇文章,请大家点个赞,以示鼓励。喜欢我就关注一下哦,...
-
香港为什么那么多新增病例什么原因?香港此处疫情源头是什么找到
提醒:戴口罩。上下班 工作中要佩戴口罩,如果有发热咳嗽等症状时就医时、拥挤时、乘电梯时、乘坐公共交通工具时、进入人员密集等公共场所
-
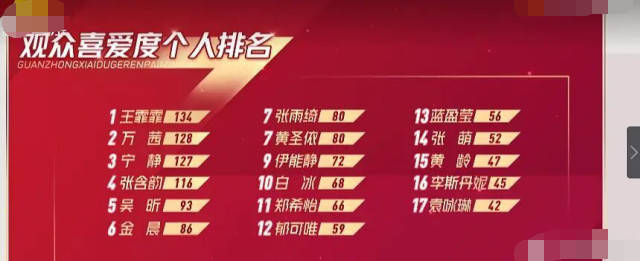
霏霏观众喜爱度第一 张雨绮跌出前五!
【导读】今日王霏霏观众喜爱度第一引发关注,我们都知道王霏霏是从韩国回来的女团实力优秀,唱跳俱佳,专业水平高,王菲菲哪些观众喜爱...
-
科学家对鲸鱼的基因组进行测序
由英国利物浦大学的Joao Pedro de Magalhaes博士领导的一个基因研究小组对神秘的鲸鱼(Balaena mysticetus)的基因组进行了测序。弓头鲸
-
快递有可能携带新冠病毒吗?疫情期间收取快递会感染新冠病毒吗
想必大家都知道,新冠病毒可以通过物体传播,也就是说新冠病毒停留在物体表面后,人类触碰后再接触嘴巴和鼻子,就有可能感染病毒。那么...
-
刘德华的老婆是哪一位叫什么名字资料 刘德华到底有没有生二胎?
刘德华老婆叫什么名字?刘德华有生二胎吗?而对于刘德华老婆叫什么名字的这个话题,今天的你是否也在关注着?具体什么情况?下面跟小编一起来了