首获FDA突破性疗法认定的本土抗癌药
今年1月,一条喜讯在医药人的朋友圈刷屏:美国FDA宣布,授予百济神州BTK抑制剂zanubrutinib突破性疗法认定,用于治疗经治的成年套细胞淋巴瘤(MCL)患者。这是中国本土研发的抗癌疗法首次获得FDA突破性疗法认定,堪称“零的突破”。
60年前的意外发现
1952年,一名8岁的男孩被送到了儿科医生欧格登·布鲁顿(Ogden Bruton)这里。这名年轻的病人体内反复被肺炎球菌所感染,出现了严重的败血症。这种罕见的症状表明,患者的免疫力有着极大的缺陷。而后续的分析也证实了布鲁顿医生的判断——生化分析结果表明,患者的血清里先天缺乏一类丙种免疫球蛋白。这也是人类历史上首次对这种疾病进行记录。
在确定这种疾病的存在后,人们又发现了不少新的病例,并开始使用体外输注免疫球蛋白,来对这些患者进行治疗。从结果上看,这种疗法非常有效,并能有效预防患者的感染。但限于当时的科学进展,医生们并不知道是什么原因导致了这种罕见疾病的发生。
1953年,随着DNA双螺旋结构得到揭示,分子生物学的发展可谓是日新月异。也正是由于这些进展,科学家们才有机会理解该疾病背后的原因。在DNA双螺旋结构提出的40年后,两个实验室宣布,分离出了导致这种免疫缺陷的基因,它编码的是一类酪氨酸激酶。为了纪念这种疾病的最初记录者,科学界将其命名为布鲁顿氏酪氨酸激酶(Bruton's tyrosine kinase),缩写是BTK。
这是人们发现的首个能导致原发性免疫缺陷的酪氨酸激酶。但当时的人们没有想到,几年后,它竟然成为了治疗血液癌症的关键。
从免疫疾病到血液癌症
后续的研究发现,BTK对于B淋巴细胞的发育和生长有着极为重要的作用。当BTK基因由于突变而失活时,骨髓里的B细胞就无法发育成熟。这正是布鲁顿医生所接手的患者体内缺乏免疫球蛋白的原因。
然而,这还不是BTK的全部功能。在分子层面,BTK是B细胞受体(BCR)信号通路的关键组成部分。当BTK失去作用时,细胞会出现异常。而倘若它过度活跃,同样会带来病变。在许多白血病和淋巴瘤患者体内的癌细胞中,BCR信号通路经常处于异常激活的状态,而这往往意味着BTK的激活。科学家们也证实,在慢性淋巴性白血病的癌细胞里,BTK蛋白的水平有所增加。针对BTK这个靶点开发抑制剂来治疗癌症,也成为了许多新药研发人员所工作的重点。
而说到BTK抑制剂,就不得不提Imbruvica(ibrutinib)这款重磅药物。这款新药的诞生故事可谓一波三折:它最初来自知名科学家Craig Venter博士创立的Celera Genomics,源自潘峥婴博士与团队的研发。后来,在杨森制药与Pharmacyclics的合作下,这款新药得到了美国FDA的突破性疗法认定,以及最终的上市批准。自2013年首次获批以来,Imbruvica也已经获得了10个批准,治疗套细胞淋巴瘤、慢性骨髓性白血病、以及华氏巨球蛋白血症等疾病。 关于Imbruvica的研发故事,我们先前已有专文介绍,这里不再详述。
百济神州的研发策略
本次获得美国FDA突破性疗法认定的zanubrutinib,同样是一款BTK抑制剂。有趣的是,BTK最初并非是百济神州的首选靶点。
2010年,在百济神州成立之初,一切都还刚刚起步。当时,许多新锐公司建立于特定的生物技术平台之上,利用这些平台技术开发新型产品。而百济神州在这一方面,则显得更为“传统”。秉持“在中国做创新药”的理念,百济神州的初创团队在最初选择了务实与前瞻并举的研发策略——短期之内,先做一些成药可能性高、周期短的项目,解决生存问题;长期来看,要做跟别人不一样的新药,做到真正创新。
但这并不是简单地做“me-too”或“me-better”。百济神州向我们透露,当时对靶点的选择有两大原则。首先,这个靶点在概念验证(proof of concept)上,已经有了明确的数据支持,但市场上不一定已经有了药物;其次,科学家们要对靶点及化合物有充分了解,知道哪些方面可以做出差异化,具备做出“best-in-class”的潜质。
基于这两大原则,百济神州快速启动了多个项目,并很快收获了积极的成果。其中,一款叫做BGB-283(lifirafenib)的RAF抑制剂能够创新地抑制RAF单聚体和双聚体,另一款名为BGB-290(pamiparib)的小分子也能够有效抑制PARP1与PARP2。这两款创新分子的开发,为当时尚处于襁褓中的百济神州带来了关键的合作资金。这也让研发人员能够站稳脚步,将目光投向下一个靶点。
而他们的选择,就是BTK。
逢山开路,遇水搭桥
之所以选择BTK,也是经过了研究人员们的深思熟虑。首先,这是一个明确可行的靶点,在2期临床中得到了概念验证。其次,ibrutinib当时尚未获批,患者存在未竟的医疗需求。
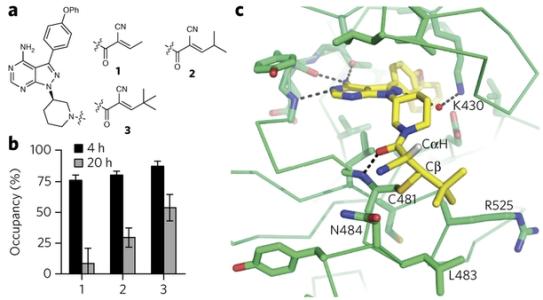
但百济神州的管理团队并不想简单重复ibrutinib的成功。相反,他们立下的题目是如何优化BTK抑制剂的研发——每个成药的化合物都有其优势与弱点。对于现有的BTK抑制剂,选择性与吸收性是两个有待提高的环节:选择性越高,潜在副作用就越小;吸收性越好,达到同样靶点抑制率所需的剂量就越低,进一步减少毒性,从而增大治疗窗口。
带着这两大目标,2012年7月,BTK抑制剂的开发正式立项。而百济神州化学与生物部门紧密合作下所应用的一类新型测试,极大地推进了这款新药的研发进程。在通常的新药研发中,我们会先把癌症接种在小鼠身上,再喂给小鼠不同的化合物,观察肿瘤是否能得到抑制,乃至消失。这个过程从实验动物的准备,到肿瘤的生长与测量,至少也需要1到2个月的时间。
百济神州的科学家们使用了一种更快的方法。由于BTK抑制剂需要和靶点共价结合,研究人员们决定使用抗体技术,直接分析有多少靶点尚未被化合物所占领。通常耗时几个月的工作,可以缩短到天——给小鼠喂食化合物后,等待4-8个小时,就可以抽血进行靶点占有率的检测。
在新型测试的协助下,研究人员们快速缩小了筛选的范围。从最初合成的500多个化合物,到进入药效动力学(PD)实验的10多个化合物,再到药效试验确定的5-6个化合物,再到基于成药性、剂型、以及物理性质等特性选定的最终候选分子,百济神州只花了5个月的时间。
这款分子被命名为BGB-3111。这个代号表示它是百济神州成立之后,做出的第3111个化合物。
在确定了晶型与合成放大途径之后,2013年4月,百济神州递交了专利申请。这是一项从中国专利局出发的全球专利,也让BGB-3111成为了不折不扣的中国本土抗癌药。
突破性疗法的诞生
BGB-3111的成功筛选,只是一个开端。接下来,它要面对的是最为关键的考验——临床试验。据估计,一款新药在临床试验中的失败概率,可能高达90%。
而在临床试验的推进上,百济神州没有任何犹豫。递交专利之后,百济神州迅速完成了制剂研发方面的工作。2014年5月,百济神州首先在澳大利亚递交了临床试验的申请。当年7月,第一批临床批次的BGB-3111胶囊生产问世,而患者的招募工作也恰好在同一时段完成。2014年8月,BGB-3111在澳大利亚完成了首名患者的给药。
此时,距离百济神州对BTK抑制剂的立项,仅过去了2年零1个月。
2016年,百济神州得到WHO确认,将BGB-3111正式命名为“zanubrutinib”。 2016年7月,zanubrutinib在中国进入临床,2017年1月,全球3期注册性临床试验启动。如今,它在全球的临床试验中,已经治疗超过了1300名患者,治疗的疾病范围包括华氏巨球蛋白血症(Waldenström macroglobulinemia,3期临床试验)、初治的慢性淋巴性白血病/小淋巴细胞淋巴瘤(CLL/SLL,3期临床试验)、复发/难治性滤泡性淋巴瘤(2期临床试验)、以及套细胞淋巴瘤(2期临床试验)。
2018年12月,百济神州在美国血液病学会(ASH)年会上公布了zanubrutinib治疗套细胞淋巴瘤的2期临床试验结果。在85名可评估的患者中,由独立评审委员会确认,有84%的患者得到了客观缓解(ORR),而完全缓解率(CR)达到了59%。在副作用方面,最常见的是中性粒细胞计数下降、上呼吸道感染、以及皮疹。研究人员们没有观察到房颤或肿瘤溶解综合征等BTK抑制剂的常见潜在隐患,再次证明了新一代BTK抑制剂有着更好的安全性。
基于zanubrutinib在套细胞淋巴瘤的临床试验中展现出的积极结果,美国FDA已授予其突破性疗法认定,以期加快它的开发与审评。百济神州计划于2019年下半年或2020年初向FDA提交新药上市申请。
在中国,zanubrutinib距离患者则更近了一步。去年8月和10月,其治疗套细胞淋巴瘤和慢性淋巴性白血病/小淋巴细胞淋巴瘤的新药上市申请先后获得NMPA受理。如今,这两项适应症的申请都已经被纳入优先审评品种,有望加快在中国上市的步伐。
后记
一款药物的研发背后,是一整个团队的努力。百济神州充分发挥了作为一家创新生物技术的公司的优势,以极高的效率进行了决策沟通,快速推进着项目的前进。Zanubrutinib从立项到首例患者给药仅花了2年出头的时间,也充分证明了这支研发团队的专业与高效。
这是属于中国医药人的荣光。
我们期待这款创新疗法能够顺利获批上市,造福患者。我们也期待百济神州能在未来再获突破,从中国真正走出去,满足全球病患的未竟医疗需求,真正实现“百创新药,济世惠民”。
特别感谢百济神州高级副总裁,化学首席研发总监王志伟博士为本文提供相关资料,并提供修改建议。
推荐内容
-
董明珠为什么看中孟羽童什么关系?孟羽童个人资料直播间叫什么名
李国庆称炒作董明珠秘书走红是要带货是怎么回事?什么情况?据消息显示,近日就有一则关于李国庆称炒作董明珠秘书走红是要带货的消息引起...
-
12月6日石家庄涉疫区疫情流调最新消息公布 河北石家庄已流调
河北石家庄已流调5208人 均采取管控措施。那么,对于河北石家庄疫情的这个话题,今天的你是否也在关注着?具体什么情况?下面跟小编一起来了
-
梦华录讲的是什么故事原著小说好看吗?陈晓刘亦菲主演的梦华录播
【导读】你知道《梦华录》吗?据消息显示,梦华录是改编自经典小说《救风尘》,剧情围绕了三个女主人公遭遇渣男后专心搞事业的故事,《救风
-
7月7日香港疫情最新数据公布 香港新冠变种病毒“零号患者”被判刑
隐瞒,致千人强制检疫!香港新冠变种病毒零号患者被判刑。那么,对于香港疫情的这个话题,今天的你是否也在关注着?具体什么情况?下面跟小编
-
单次有氧运动可以提高老年人的认知和记忆能力
爱荷华大学的一组研究人员发现,一次有氧运动可以改善老年人的认知功能和工作记忆。该研究结果发表在杂志中体育与运动医学与科学。最近...
-
张静初吃肉什么意思什么梗?张静初为什么叫公交车原因
想必这两天,大家对于张静初吃肉什么梗一事是非常关注的,具体是什么情况呢?为什么会发生这样的事呢?下面跟小编一起来了解下事件始末。...
-
华海药业盐酸强力霉素缓释片50mg规格的补充申请获FDA批准
浙江华海药业21日发布晚间公告称,近日收到美国FDA的通知,公司向美国FDA申报的盐酸强力霉素缓释片新增规格的补充申请(sANDA,即美国仿制药
-
智利南极基地暴发疫情 36人感染新冠病毒26人为陆军成员
看到的这两个消息都挺暴烈的。一个是被称作地球上最后一块净土的南极也沦陷了,一个是新冠病毒开始在世界的不同地区产生不同的变异,今...
-
陷入困境的蜜蜂被变形的翼病毒击中
研究人员周三表示,一种变形的病毒缩短了野生蜜蜂的寿命,这些蜜蜂已经与一系列令人吃惊的生存威胁相抗衡。通过微观螨虫传播,微生物破...
-
以色列约70%病例感染自美国病毒株 70%这个数据简直了
以色列约70%病例感染自美国病毒株