ABCG2突变转运蛋白的低温电子显微镜结构
转运蛋白ABCG2属于ATP结合盒(ABC)家族。蛋白质在多种组织和组织屏障内的细胞质膜中表达,包括血脑,血睾和母胎屏障。蛋白质可由ATP提供动力以转移内源底物,影响许多药物的药代动力学并防止多种异生素,包括抗癌药物,尤其是乳腺癌。ABCG2通常被称为乳腺癌耐药蛋白,其中先前的研究揭示了ABCG2结构和ABCG2抑制的结构基础用小分子和抗体。ABCG2的底物识别机制以及ATP驱动的运输能力仍有待确定。
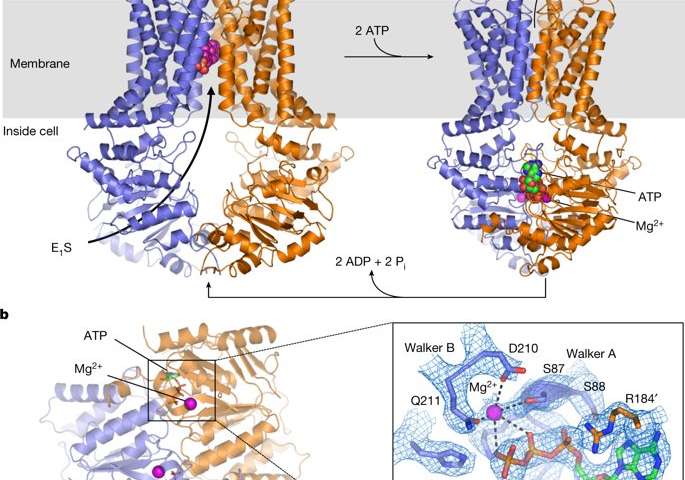
在现在发表在Nature上的一份新报告中,Ioannis Manolaridis及其同事提出了人类ABCG2的高分辨率低温电子显微镜结构,其基底结合前转位状态和ATP结合后易位状态。科学家使用含有谷氨酰胺的突变蛋白代替催化谷氨酸(ABCG2 EQ)来观察这两种状态。突变体ABCG2 EQ显示降低的ATP酶和转运速率,以使构象捕获适合于结构研究。在研究的底物结合状态中,在面向细胞质的腔中大约穿过膜的一半,整合了单分子的雌酮-3-硫酸酯(E 1 S)用于功能研究。
由于ATP诱导的构象变化,枢转核苷酸结合结构域(NBD)和相对NBD亚结构域方向的变化,观察到跨膜结构域的刚体移位。在其作用机制中,ABCG2利用ATP结合的能量来挤出E 1 S和其他内源底物。基于化合物的大小和结合亲和力,因此可以在研究中区分底物和抑制剂。
转运蛋白ABCG2属于ATP结合盒(ABC)家族。蛋白质在多种组织和组织屏障内的细胞质膜中表达,包括血脑,血睾和母胎屏障。蛋白质可由ATP提供动力以转移内源底物,影响许多药物的药代动力学并防止多种异生素,包括抗癌药物,尤其是乳腺癌。ABCG2通常被称为乳腺癌耐药蛋白,其中先前的研究揭示了ABCG2结构和ABCG2抑制的结构基础用小分子和抗体。ABCG2的底物识别机制以及ATP驱动的运输能力仍有待确定。
在现在发表在Nature上的一份新报告中,Ioannis Manolaridis及其同事提出了人类ABCG2的高分辨率低温电子显微镜结构,其基底结合前转位状态和ATP结合后易位状态。科学家使用含有谷氨酰胺的突变蛋白代替催化谷氨酸(ABCG2 EQ)来观察这两种状态。突变体ABCG2 EQ显示降低的ATP酶和转运速率,以使构象捕获适合于结构研究。在研究的底物结合状态中,在面向细胞质的腔中大约穿过膜的一半,整合了单分子的雌酮-3-硫酸酯(E 1 S)用于功能研究。
由于ATP诱导的构象变化,枢转核苷酸结合结构域(NBD)和相对NBD亚结构域方向的变化,观察到跨膜结构域的刚体移位。在其作用机制中,ABCG2利用ATP结合的能量来挤出E 1 S和其他内源底物。基于化合物的大小和结合亲和力,因此可以在研究中区分底物和抑制剂。
作者首先确定用Walker B基序中的谷氨酰胺替代催化谷氨酸E211(磷酸盐结合序列)将导致突变体大大减少(尽管未消除)ATP水解和E 1 S转运活性。为了确定E 1 S结合结构,将单克隆抗体5D3(5D3-Fab)的抗原结合片段添加到样品中 - 其结合ABCG2的外表面,以促进高分辨率结构测定。在ATP水解减慢通过加入5D3-FAB的抑制脂质体的重建ABCG2的和转运活性,而不会影响ABCG2和E之间的相互作用1小号衬底。ABCG2 EQ 复合物显示出内部开放的构象,总分辨率为3.6,以清楚地显示跨膜结构域和底物结合腔。
作者观察到由ABCG2单体的底物结合腔中的跨膜(TM)螺旋TM2和TM5a形成的密度特征。密度特征可以在两个方向上结合一个E 1 S底物,尽管由于多环体系的空间碰撞,两个E 1 S分子不能同时结合。底物结合腔还可以容纳抑制剂,证明其在底物和多药结合中的双重作用。
在这项研究中,科学家们为ABCG2 EQ -E 1 S 产生了单点突变,以确定所得突变体变体的ATP酶活性和E 1 S转运。所有测试的突变体的稳定性显示与天然野生型蛋白质的相似性,允许直接比较。例如,V546F突变体具有受损的转运活性,但ATP酶活性增加12倍,尽管E 1 S以浓度依赖性方式抑制。该结果表明,将两个苯环引入底物腔中使得能够与底物结合模拟ATP酶活性刺激,但进一步包含E 1S'堵塞了'转运蛋白'。其他突变体变体的结果与研究中的野生型蛋白质相比有所不同,强调了结合腔对修饰的敏感性。
使用低温-EM显微术进行的其他功能研究表明,ATP结合导致NBD(核苷酸结合结构域)的α-螺旋结构域旋转35度以进行二聚化,从而在运输周期中实现“动力中风”。在每个ABCG2单体中,单个跨膜核苷酸结合结构域界面在无核苷酸和ATP结合状态之间保持基本不变。然而,ATP诱导的构象变化引发NBD的变化,导致跨膜结构域(TMD)的细胞质成分彼此推向。这种ATP诱导的构象变化在底物转运途径中具有重要作用。
在结构上处于ATP结合状态的ABCG2 EQ -E I S中,苯环相互堆叠,使基板弯曲腔塌缩而没有空间用于结合的基板。对于穿过膜的运输,基质必须在运输器的中心移动通过易位通路,以在通路完全关闭之前到达外腔。对于该过程,必须发生类似蠕动运动的瞬时构象变化以产生基板的空间。
作者假设底物可以通过细胞质或通过脂质双层内的“膜入口”结合。一旦结合,NBD二聚体只能在基质移出基质结合腔时关闭。在生产性运输周期中,假定基质通过“亮氨酸塞”在运输者的中心移动通过易位途径。一旦底物清除了插塞区域,ATP结合的ABCG2 EQ的结构表明插塞区域闭合,并且底物被释放到外部。
该研究的一个警告是,E211Q突变可能影响了所涉及的构象变化的能量学。该发现表明ATP结合可能足以进行底物挤出步骤,并且转运蛋白可以通过ATP水解重置为面向内的构象。与其他转运蛋白不同,ABCG2似乎在底物结合时不形成稳定的,闭塞的构象,但表现出类似于细菌BtuCD-F转运蛋白的蠕动样机制的瞬时构象。
使用多特异性多药转运蛋白(如ABCG2)仍未解决的一个关键问题是为什么某些化合物作为底物,而其他化合物则作为有效的抑制剂。当作者比较ABCG2底物与两种有效抑制剂的结合模式时,所有三种分子都与转运蛋白的同一腔结合。该研究进一步表明,当底物E I S和ATP一起结合ABCG2时,插塞的开口允许底物被推入外腔。相反,通过将结构锁定在面向内的构象中,抑制剂充当楔子以固定转运蛋白。该研究表明,化合物的大小和结合亲和力对于转运蛋白中的易位是重要的,从而允许区分底物和抑制剂。该工作为进一步了解转运蛋白 ABCG2的动力学提供了新的见解。
推荐内容
-
8月23日郑州新冠肺炎疫情防控最新消息公布 郑州两地降为低风险
郑州两地降为低风险地区,多个小区解除封控管理。那么,对于郑州疫情的这个话题,今天的你是否也在关注着?具体什么情况?下面跟小编一起...
-
4月21日云南新增境外输入确诊病例1例 今日云南疫情最新数据情
自疫情爆发以来,想必大家对数据变化都十分关注,疫情传来好消息或坏消息都会关系到人们的生活,也会影响人们对疫情的心态。据最新消息显...
-
6月1日起可以使用电子驾照 怎么办理电子驾驶证?
【 6月1日起可以使用电子驾照 】关于驾驶证电子化6月1日起在3个城市试点,什么是驾驶证电子化的这个话题,相信小伙伴们是非常有兴趣了解的,
-
北京丰台新兴家园疫情开始时间是什么时候结束?丰台新兴家园疫情
温馨提示:一旦出现发热、干咳、乏力、鼻塞、流涕、咽痛、嗅觉味觉减退、结膜炎、肌痛和腹泻等症状,应及时按规范程序就诊,并主动告知1...
-
被顶替农家女想重新入学遭拒 到底是顶替者父亲在说谎?
被顶替农家女想重新入学遭拒今日引发争议,高考作为我国重大政策不能有漏洞,上大学是大多数人心中的理想,这些心怀大学梦的被顶替者本...
-
11月15日西安市疫情最新实时消息公布 西安钟鼓楼博物馆今日恢复开放
西安钟鼓楼博物馆今日恢复开放!暂不接待中、高风险等级地区游客。那么,对于西安疫情的这个话题,今天的你是否也在关注着?具体什么情况?下
-
湖北省新冠肺炎疫情情况 新增无症状感染者22例
新冠肺炎防疫工作可以说是已经结束了,但是近来还是有一些无症状病例偶然出现,根据最新数据显示湖北新增无症状感染者22例那么来看看具...
-
山东青岛疫情源头在哪儿?为什么青岛会出现疫情原因
山东青岛疫情源头在哪儿?青岛为什么会突然爆发此次疫情?我们需要注意些什么?10月12日的《新闻1+1》连线中南大学湘雅医院感染控制中心教授吴
-
3月21日钦州市钦北区疫情消息情况公布 昨日,钦北区2个自然村划
广西钦州市钦北区2个自然村划分为中风险地区。据消息显示,广西钦州市钦北区新型冠状病毒感染的肺炎疫情防控工作领导小组指挥部2022年3月20
-
8月21日河北大名疫情防控最新消息公布 适龄无接种禁忌人群应该
温馨提示:尚未接种新冠病毒疫苗的群众(有接种禁忌症除外),请尽快持本人身份证到附近的接种点完成疫苗接种。继续加强个人防护意识,养...