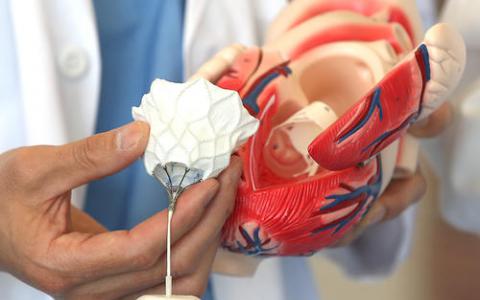
FDA将囊性纤维化治疗批准扩大到6至12岁的儿童
美国食品和药物管理局今天宣布,囊性纤维化治疗Symdeko(tezacaftor / ivacaftor)片的适应症已经扩展到治疗6岁及以上患有囊性纤维化和某些基因突变的儿童。
Symdeko被批准用于治疗患有两个拷贝的F508del突变(最常见的突变类型)和CFTR基因中至少有一个突变的患者,这些突变对Symdeko中的活性成分有反应。美国食品药品管理局去年批准Symdeko用于12岁及以上儿童的相同基因突变治疗。6至12岁重量小于30公斤的儿童的剂量是早上50毫克tezacaftor和75毫克ivacaftor的一片,大约12小时后一片75毫克ivacaftor。在12岁及以上或体重30kg或以上的患者中,剂量是一片含有100mg tezacaftor和150mg ivacaftor的片剂和12小时后含有150mg ivacaftor的片剂。
Symdeko的批准是基于三项3期,双盲,安慰剂对照试验,显示肺功能改善和急性加重减少。6岁至12岁儿童的扩大适应症是基于12岁及以上患者的数据以及6至12岁患者的数据的额外支持。Symdeko对6岁至12岁的70名囊性纤维化患者进行了为期24周的开放性研究,证实了Symdeko对6至12岁儿童的安全性。
Symdeko的标签表明它应该始终与含脂肪的食物一起服用,不应与某些抗生素,癫痫药物,圣约翰草或含有葡萄柚或塞维利亚橙的食物混合使用。该处方信息包括转氨酶升高的警告和对儿童服用Symdeko白内障的风险,并警告不要与CYP3A诱导剂同时服用Symdeko。最常见的副作用是头痛,恶心,鼻窦充血和头晕。
推荐内容
-
测试设计的碳材料以净化废水
来自工业和农业的废物流可用于生产煤,其可用作水净化的廉价吸附剂。Mirva Niinipuu在工业博士学院的论文中表明,碳材料分离有机水污染的
-
12月11日浙江云南内蒙古疫情最新数据公布 昨日新增本土病例51例
提醒:坚持非必须不出境、不去中高风险地区。有中高风险地区旅居史的人员,请配合落实14天(自离开中高风险地区之日起)的隔离医学观察。中高
-
行业研究显示 Medtech研发适应新压力
由AdvaMed和Deloitte对22家医疗技术公司进行的联合调查发现,该行业正在通过分散投资组合并加快新产品的上市时间来应对市场和监管变化的压
-
Arc Bio在ASM临床病毒学研讨会上介绍了Galileo病原体解决方案产品系列
Arc Bio今天在Savannah的ASM临床病毒学研讨会(CVS)上推出了GalileoTM病原体解决方案(GPS)产品系列。随着这一消息的出现,早期接入商用版GP
-
11月20日哈尔滨市平房区疫情最新数据公布 昨日,哈尔滨市平
想必大家都知道,哈尔滨,简称哈,别称冰城,黑龙江省辖地级市,是中华人民共和国黑龙江省省会、副省级市、哈尔滨都市圈核心城市。那么...
-
钟南山预计全球疫情3月起才会下降 2021年疫情3月份能结束吗
钟南山预计全球疫情3月起才会下降,3月之后,属于我们的三阶段挑战要来了。如何让群众放心接种疫苗,如何让疫苗跑的比疫情快。1月31日,中
-
2021上海什么时候入梅出梅 2021年上海入梅出梅时间介绍
气象上的梅雨是泛指初夏向盛夏过渡的一段阴雨天气。进入梅雨期。各地气候时节不同,入梅期也各不同。那么,你知道上海入梅出梅的时间分...
-
1.10新乡疫情最新信息公布 昨日,河南新乡暂停线下教学工作
【 河南新乡暂停线下教学工作 】1月9日,新乡市教育系统新冠肺炎疫情防控工作专班办公室发布关于暂停线下教学工作的紧急通知,全文如下:当
-
北斗三号收官之星点火升空 北斗到底是什么?
【导读】今日北斗三号收官之星点火升空引发关注,但其实还有人不知道北斗到底是什么?信息时代的今天,当我们需要去一个陌生的地方时,只需