这种实验性疫苗产生的抗体可以中和多种艾滋病毒畸形
由研究科学家和斯克里普斯的非营利疫苗研究组织IAVI开发的一种实验性艾滋病毒疫苗,通过提取能够中和多种艾滋病毒畸形的抗体,已经达到了一个重要的里程碑。

在兔子身上进行的测试显示,这些“广泛中和”抗体(bnAbs)至少指向病毒中的两个关键部位。研究人员普遍认为,如果一种疫苗要对这种不断变化的病毒提供强有力的保护,就必须将bnAbs从艾滋病毒的多个位点清除出去。
在免疫学中出现的有希望的结果表明,研究人员离研制出一种有效的艾滋病毒疫苗又近了一步——这是自1983年该病毒被确定以来医学科学的一个重要目标。
这是对原则的初步测试,但很重要,我们现在正在努力优化这种疫苗设计。
理查德·怀亚特,博士,斯克里普斯研究免疫学和微生物学系高级教授
根据联合国艾滋病规划署(UNAIDS)的数据,全世界约有3500万人死于由艾滋病毒感染引起的免疫缺陷综合症(aids)。另有3800万人感染了艾滋病毒。抗病毒药物可以使艾滋病毒感染者保持活跃,降低他们将病毒传播给他人的能力,但这些药物并非没有感染障碍,必须无限期服用。研究人员长期以来一直认识到,有必要消除艾滋病毒这一重大公共卫生威胁,为未受感染的人提供廉价的预防疫苗。
艾滋病毒快速变异方案和其他避免免疫攻击的机制使其成为疫苗设计人员的一个极其困难的目标。但是怀亚特和他的人进行的测试证实,疫苗接种可以产生对艾滋病毒提供全面保护所必需的抗体。这些bnAbs,正如疫苗专家所称,可以中和多种艾滋病毒畸形,因为它们与病毒中的关键部位相连,这些部位在变形过程中变化不大。感染bnAbs的人有时会产生艾滋病毒,这是他们抗体反应的一部分,但很少发生,而且通常是在感染长期确立之后。艾滋病毒疫苗设计人员面临的主要挑战是找到方法,通过制造bnAbs来增强大多数或所有人的免疫系统,这些bnAbs将病毒中的多个脆弱位点粘在一起,以防止大量艾滋病毒畸形。
怀亚特及其同事的疫苗设计的核心是一种基于艾滋病毒“ENV”蛋白的病毒模仿蛋白。通常情况下,ENV蛋白的多个布什样副本会在每个球形hiv粒子的表面扩散。ENV中的每一种蛋白质都包含一种分子机制,使其能够与免疫细胞中被称为CD4的受体结合,并将该受体作为细胞中分裂的门户。研究人员开发了一种环境模型,该模型在实际环境中模拟了基本结构,同时作为疫苗使用相当稳定。现在,他以一种类似于hiv病毒的真实粒子的方式,创造了由与脂肪相关的分子组成的病毒分类的合成球体,即“脂质体”,这些脂质体被ENV靶向蛋白高密度标记。
在一种天然的hiv - ENV蛋白中,糖分相关分子的簇状体被称为糖分辅助外壳,通常是免疫攻击CD4的关键环节。作为“诱饵”的初始免疫接种,研究人员使用了ENV版本,其中CD4连接点周围的糖化外壳部分被移除。
怀亚特说:“我们的想法是改善这个部位的暴露,从而在一开始就刺激抗体对它的广泛反应。”
随后48周的辅助扩增免疫使用ENV蛋白和重新建立的葡聚糖来选择指向CD4结合点的抗体,但也可以通过该胸罩。辅助放大器镜头中的ENV蛋白也是基于各种艾滋病毒畸变的混合物,通常是针对这些畸变之间没有变化的ENV结构的抗体反应。
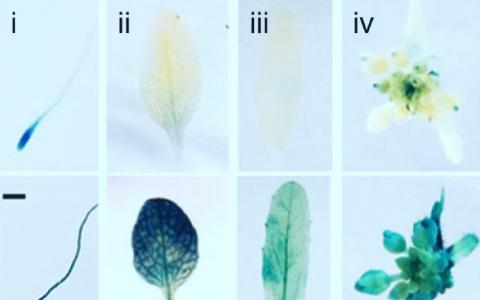
这些人在接种疫苗后接种了12只兔子,并将结果与只接种了单一版本的乙肝疫苗的对照组进行了比较。他们发现他们的疫苗接种策略有更好的反应,其中5只兔子产生了可以中和多重艾滋病毒的抗体。
研究人员分析了反应最强烈的兔子的抗体,并确定了两种不同类型的bnAb。其中一种被称为E70,它像预期的那样,以一种不同寻常的方式盲掉了CD4连接点——部分原因是它抓住了被屏蔽的聚糖。另一个是1C2,它在ENV中粘贴了一个不同但众所周知的脆弱位点,在复合物的两个主要片段之间的界面上。1C2抗体的堵塞似乎破坏了环境病毒的稳定,因此它不能再介导艾滋病毒在宿主细胞中的位置。这种抗体还具有不同寻常的中和宽度,使208种不同的艾滋病毒隔离物中的87%失明。
怀亚特说,这一发现是一个重要的证据,证明如果以正确的方式接种艾滋病毒疫苗,就可以实现将bnAbs诱导到病毒多个位点的目标。
科学家们正在继续在小型动物模型中测试和完善他们的疫苗策略,并希望最终在订书钉和人类身上进行测试。
推荐内容
-
8月6日辽宁沈阳疫情最新实时数据公布 沈阳累计排查到各类密接者1
你知道沈阳疫情目前什么情况吗?沈阳疫情有几人确诊了?据消息显示,沈阳昨日无新增,目前累计排查到各类密接者1688人,1550人已解除隔离。8
-
生物学家揭开了开花植物的记忆机制
来自英国和荷兰的一组研究人员已经确定了一种机制,使被子植物(开花植物)能够感知并记住其环境的变化。植物的记忆功能使它们能够根据压...
-
从种子生长为克隆的水稻植物
加利福尼亚大学戴维斯分校的植物生物学家发现了一种通过种子作为克隆使作物植物复制的方法。这一发现长期以来一直受到植物育种者和遗传...
-
汕头明润是什么公司?汕头明润乒乓球俱乐部老板是谁资料简介
你知道汕头明润实业发展有限公司是什么公司吗?据消息显示,据天眼查信息,汕头明润成立于2016年12月07日,法定代表人为林培生,注册资本为1
-
青岛新增2例本地无症状感染者 山东无新增本地疑似病例
【导读】疫情期间大家最关心的话题莫过于新冠肺炎疫情的最新动态,今日青岛2例无症状感染者详情公布,据悉青岛新增2例本地无症状感染者...
-
科普血液也要排毒及感冒不能吃酸
零食是你的最爱,肉食爱好者,少吃蔬菜有糖尿病、高血压的家族史,没时间吃早餐吸烟一族,工作日经常加班月经极其不正常,口味重晚餐是...
-
美联储的股东名单都有谁?美联储是私人的还是国家的
你知道美联储的股东是谁吗?美联储是私人的还是国家的?而对于美联储的股东是谁的这个话题,今天的你是否也在关注着?具体什么情况?下面跟小编
-
韩国N号房案件最新消息 主犯之一获刑7年
据韩国媒体报道,N号房事件的主犯之一、Watchman全某被判处7年有期徒刑。从去年4月到9月,他在加密聊天软件中建立了几个聊天群来发布非法视
-
乒乓球陈梦个人资料简介 陈梦与黄晓明到底是什么关系始末介绍
【导读】陈梦是谁?据消息显示,陈梦,1994年1月15日出生于山东青岛,汉族,中国女子乒乓球队运动员。1999年开始练习乒乓球,2004年正式进入
-
恒大夏海钧的真实身份是什么?年薪多少 夏海钧是谁哪里人个人
【导读】夏海钧是谁?据消息显示,夏海钧,1964年出生于哈尔滨,先后毕业于中南大学、暨南大学,获金属材料专业学士、工商管理硕士(MBA)、产