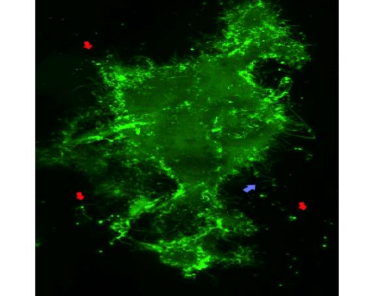
研究人员揭示了脑细胞受体表面的新活动
就像漂浮在海洋上的浮标一样,许多受体漂浮在细胞膜的表面,一部分粘在水面上,另一部分粘在水下,在细胞的细胞质中。但要使细胞发挥作用,这些受体必须停靠在细胞的特定区域。大多数研究都集中在水下部分。这就是细胞的分子机器聚集在一起并与受体的水下尾巴相互作用的地方,然后这些相互作用激发了深入细胞核的信号,改变了细胞的过程。

托马斯·杰斐逊大学的一个研究小组的新工作揭示了表面上的新活动,在控制学习和慢性疼痛的脑细胞受体中。在这项研究中,作者表明,蛋白质的“高于水”部分可以帮助将蛋白质停靠在突触上,神经元在突触上介导整个大脑的信息流。这一发现打开了使用这个对接站点作为目标的可能性,以开发治疗慢性疼痛和其他疾病的更有效的方法..这项研究于1月29日发表在《自然通讯》上。
“细胞外的空间——水上方的部分——基本上被忽视了,”高级作者马修·达尔瓦说,他是博士,是神经科学系的教授和副主任,也是维基和杰克神经科学研究所杰斐逊健康中心的主任。德尔瓦博士和他的研究小组观察了脑细胞上的NMDA R受体,并确定了该受体与邻居相互作用以启动信号的部位。“当尝试开发新的疗法时,找到牛眼是问题的一半,”达尔瓦博士说。
找到一个位于细胞表面上方的关键相互作用,可以使它更容易被治疗学所接受。
我们所谈论的受体相互作用的种类与当受体与细胞外的配体结合时不同,这是有充分记录的。在这里,我们描述了各种生化交换-由自由漂浮的ATP推动的激酶磷酸化-直到最近,我们一直认为这些交换是细胞内部独有的。”
Mat thew Dalva博士,资深作者
研究人员重点研究了名为NMDA型谷氨酸受体(NMDARs)的突触蛋白,它有助于调节神经元之间突触连接的强度。重要的是,突触连接要强,但不要太强,以防止建立一个过度兴奋的连接。
控制突触强度的一个关键机制是由于与另一种称为EphB受体酪氨酸激酶的突触蛋白的直接分子相互作用而增加NMDA R功能。Dalva博士和他的同事先前已经证明,EphB在分子的“外部”或细胞外部分的磷酸化可以导致与NMDARs的直接相互作用。这种化学交换导致受体聚集和驱动神经元可塑性和慢性疼痛(PlosBiology2017)。他们的新工作确定了NMDA R或牛眼的特定区域,这些蛋白质相互作用所必需的。
这种特定的牛眼可能有重要的医学意义,因为EphB-NMD AR相互作用的中断与阿尔茨海默病有关,在慢性疼痛中可能是由于这种相互作用过多所致。作为跨突触组织者和NMDA R结合蛋白,EphB受体是这些事件的关键调节因子..
然而,尽管十多年前发现了这种相互作用,NMD AR与EphB交互的确切位置一直是个谜。在这里,研究人员证明NDMA R铰链区域的特定氨基酸需要与EphB2相互作用。重要的是,铰链区的氨基酸是需要适当的NDMA R迁移和稳定在突触。
“越来越多的证据表明,细胞外的相互作用可能在从疼痛到癌症甚至疟疾等疾病中发挥关键的调节作用,”达尔瓦博士说。“当我们开始定义这些交流的样子时,我们将能够研究它们,了解它们对疾病的贡献,并有可能利用它们找到更好的医疗干预措施。”
推荐内容
-
11月13日郑州荥阳市疫情最新数据公布 郑州通报新增确诊病例和
温馨提示:一旦出现发热、干咳、乏力、鼻塞、流涕、咽痛、嗅觉味觉减退、结膜炎、肌痛和腹泻等症状,应及时按规范程序就诊,并主动告知1...
-
26岁上海富二代杀妻焚尸案怎么回事?严豪杰案件结果全过程来龙去
【摘要】男子为赌债杀妻焚尸究竟有多恐怖?据消息显示,去年3月,上海一男子赌博借了高利贷,还不出钱,问新婚妻子讨要给父亲治病的救命...
-
陈瑞丰是葛优的侄子吗家庭背景如何个人资料简介 陈瑞丰心理测试
今天一则关于葛优侄子陈瑞丰个人资料相关话题引起了网上热议,想必大家对于葛优侄子陈瑞丰个人资料一事是非常感兴趣的,既然大家都想要...
-
兽医研究确定了驯服埃博拉病毒的新目标
病毒及其宿主处于一种胜人一筹的永恒游戏中。如果宿主细胞发展出阻止病毒传播的方法,病毒将寻找新的途径。等等等等。由宾夕法尼亚大学...
-
11月20日广西疫情最新数据公布 广西昨日新增确诊病例5例
广西11月19日新增确诊病例5例、无症状感染者1例,均为境外输入。据消息显示,11月20日通报,11月19日0至24时,全区无新增本土确诊病例、疑
-
北京来福士有疫情吗是怎么回事?2021北京海淀区疫情什么时候开始的
冬季来临,疫情防控形势更加严峻,目前国内疫情仍在继续,随着医护人员一轮又一轮的筛查,确诊病例也因此被发现。那么,你知道目前北京疫情什么
-
算法创新可能有助于减少侵入性心脏手术
生使用侵入性程序来绘制患有心房颤动(心律异常)的患者的心脏,以确定消除心脏组织的消融程序是否可能具有积极的结果。计算机断层扫描(CT)扫
-
东北制药拟募资不超20亿元 持续投入维C项目
3月4日,东北制药公布定增预案,拟向包括控股股东方大集团在内的不超过10名的特定投资者发行不超过121439816股(含)股票,募集不超过20亿元
-
老鼠仓属于什么行为为什么违法?王广群老鼠仓事件是怎么回事来龙
【导读】老鼠仓属于什么行为?是什么意思?据消息显示,老鼠仓是特指证券市场中基金经理的一种违规行为。老鼠仓现象是经济发展到特定阶段,尤
-
8月9日张家界疫情最新数据公布 张家界昨日新增新型冠状病毒肺炎
积极接种新冠病毒疫苗。接种疫苗是预防新冠肺炎最好的办法,有助于建立群体免疫屏障,减缓并最终阻断疾病流行,保护个人和家人的健康。...