新技术改进了蚊子和其他物种的CRISPR-Cas9基因编辑
研究人员称,旨在改善蚊子和其他节肢动物中CRISPR-Cas9基因编辑的技术成功实现了高效率,同时消除了对遗传物质难以显微注射的需要。
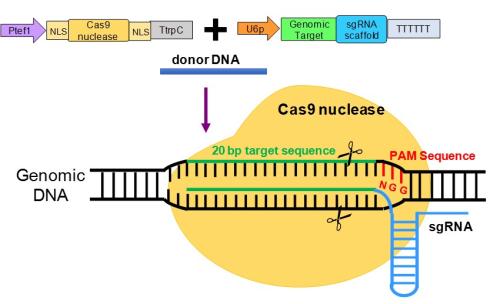
这些结果可以为科学家研究各种节肢动物 - 甚至一些脊椎动物 - 铺平道路,更容易操纵基因表达,用于基础研究和实际应用,如控制寨卡病毒和疟疾等媒介传播疾病,消灭农业昆虫害虫,以及可能用于人类和动物健康的基因疗法。
CRISPR-Clustered Regularly Interspaced Short Palindromic Repeats-是一种相对较新的革命性方法,通过精确地将DNA切割酶Cas9传递到DNA的目标区域来修饰生物体的基因组。由此产生的突变可以删除或替换特定的DNA片段,从而促进或禁用某些特征。
目前的节肢动物方法依赖于通过胚胎显微注射将基因编辑Cas9直接传递给卵子,胚胎显微注射是一种困难且低效的过程,只适用于少数物种,宾夕法尼亚州农业大学昆虫学和疾病流行病学教授Jason Rasgon指出。科学。
“此外,显微注射会损坏鸡蛋,需要昂贵的设备和培训才能实施,”他说。“这些限制极大地限制了CRISPR-Cas9技术在不同物种中的应用。”
为了解决这些限制,Rasgon的实验室开发了ReMOT控制 - 受体介导的货物卵巢转导 - 研究人员称这种方法可以通过简单注入雌性节肢动物的血液将Cas9货物运送到基因组的目标部分,在那里可以引入通过卵巢中的受体进入发育中的卵子。
Rasgon解释说,在卵巢和卵子成熟期间,蚊子和其他节肢动物合成卵黄蛋白,卵黄蛋白分泌到血液中并被带入卵巢。该团队假设来自这些蛋黄蛋白的分子可以与Cas9货物融合,并以在胚胎中实现基因组编辑所必需的水平进入卵子,从而无需胚胎显微注射。
在测试埃及伊蚊(一种可以传播登革热,基孔肯雅病毒,寨卡病毒和黄热病病毒等病原体的蚊子)中的这一假设的过程中,研究小组发现了一种称为P2C的肽,这种配体被卵巢受体识别,并在其他五种蚊子也是如此。
为了直观地显示P2C可以在卵巢中摄取,研究人员将注入绿色荧光蛋白的肽注入蚊子体内。他们随后在超过98%的原代卵母细胞中发现了荧光。
对于基因编辑实验,科学家们针对一种基因进行了研究,该基因在被淘汰时会产生白色而不是黑色,从而提供可见的表型以帮助进行筛查。他们发现,当与Cas9酶结合时,P2C能够将基因编辑货物运送到卵巢,在那里以高效率实现所需的突变,从而产生遗传修饰的后代。
最近在Nature Communications上发表的这项研究结果表明,与胚胎注射相比,ReMOT Control的基因编辑效率高,技术上更容易实现,Rasgon表示。
“虽然显微注射设备可能需要花费数千美元并且需要大量培训才能使用,但ReMOT控制注射设备的成本约为2美元,而且该技术可在不到一小时的时间内完成,”他说。
“成本注射的成本和易用性降低使得该方法比现有的胚胎注射技术有了实质性的改进,将基因编辑能力置于非专业实验室的范围内,并可能彻底改变功能性节肢动物遗传学的广泛应用。”
推荐内容
-
研究人员认为绝经后是子宫内膜癌的关键因素
子宫内膜癌是美国最常见的妇科恶性肿瘤,在女性中排名第四。另外,在西方世界,子宫内膜癌的发病率正在上升,这表明饮食,生活方式和阴...
-
教你注意这些疾病在这个季节属于高发疾病及年轻人别再自我催眠式
注意这些疾病,在这个季节属于高发疾病大家好,这里是卓医生说健康,为大家带来健康知识科普。欢迎大家关注,评论,转发。今天继续跟大...
-
堪培拉附近的野火迫使网球锦标赛转移
堪培拉,澳大利亚(美联社)-堪培拉国际网球锦标赛定于星期一开始,将搬迁到一个大约600公里(370英里)的城市,因为该地区持续的野火和...
-
驯养的动物是在人类和野生生物中传播病毒的关键
根据涉及斯旺西大学的最新研究,我们的宠物和牲畜等驯养的动物是病毒在人类和野生生物中传播的关键。然而,这项研究揭示了人类和野生动...
-
花蜜中的微生物影响授粉
将它的喙浸入花朵的甜蜜花蜜中,蜂鸟所做的不仅仅是吃饭 - 它有助于微生物群落,可能决定花朵的命运。认识到这种短暂的相互作用可能对作
-
荷兰牛栏奶粉需不需要提前囤货?还能直邮回国吗?
最近受到新型冠状病毒的影响,不少宝爸宝妈们都在家里呆着,但是也有不少妈妈私信我说,现在大人到是问题不大,不过宝宝奶粉的问题却不...
-
分享一下乙肝患者的饮食禁忌及老人的饮食不要太清淡
分享一下乙肝患者的饮食禁忌肝病是发生在肝脏的病变,常见的肝病有:乙肝、丙肝、肝硬化、脂肪肝、酒精肝、肝癌等。民以食为天,食物是...
-
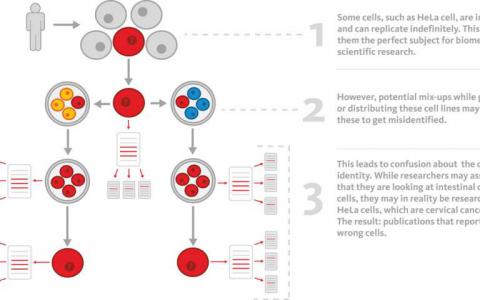
细胞系错误鉴定如何污染科学文献
几十年来,着名的HeLa细胞等永生细胞已经污染了实验室中的其他细胞培养物。因此,关于某些细胞的科学研究实际上正在讨论其他细胞。Radboud
-
研究人员开发可穿戴纸基紫外线传感器
由皇家墨尔本理工大学(RMIT University)领导的国际研究人员团队开发了基于纸张的紫外线传感器,该传感器可以帮助人们管理维生素吸收并避免
-
通过材料缺陷控制自旋相关的太赫兹电子学的一步
各种电子和光电设备中半导体的运行速度被限制在几千兆赫兹(每秒十亿次振荡)。这限制了计算操作速度的上限。现在,MPSD和孟买印度理工学院的