新特征的蛋白质相互作用可能有助于寻找新的抗癌药物
一些抗癌剂意图扰乱p97蛋白复合物的功能,这对于癌细胞的存活是必需的。Helmholtz协会(MDC)MaxDelbrück分子医学中心的一个研究小组现在已经找到了将p97复合物分解为其亚基的方法,并在Nature Communications上发表了他们的结果。
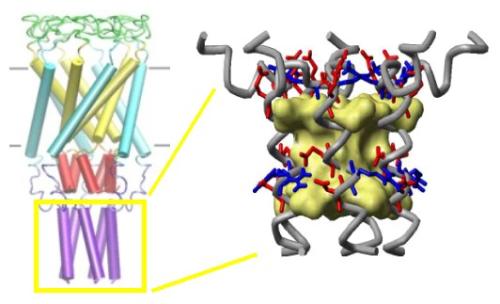
许多蛋白质组织在所谓的蛋白质复合物中,联合起来完成某些任务。环形p97蛋白复合物是这样一种分子机器,它由六个相同亚基组成,并参与处理细胞垃圾和其他任务。癌细胞产生特别大量的蛋白质,因此产生大量废物,这就是p97对其生存至关重要的原因。
因此,扰乱p97复合物的功能可能是以有针对性的方式杀死增殖的癌细胞的有希望的新方法。“我们的想法是,如果我们阻断这种蛋白质,细胞蛋白质垃圾将不会被清除,细胞就会被自己的垃圾堵住并自杀,”该项目中起主导作用的研究员Anup Arumughan博士说。一些研究小组一直试图选择性地使用药物抑制p97,但成效有限。
在MDC小组负责人Erich Wanker教授的实验室工作,并与Yvette Roske博士和Udo Heinemann教授以及其他几个MDC实验室合作,Arumughan发现了一种蛋白质,它不仅可以抑制p97机器,还可以分解p97机器。
Arumughan在酵母细胞中使用“酵母双杂交”方法来鉴定喜欢与p97结合的蛋白质。因为这种类型的酵母实验通常是不可靠的,他将其结果用作哺乳动物细胞培养的一系列新实验的基础。这种实验组合创建了与不同亲和力的p97相互作用的蛋白质目录。
在测试中出现了一种具有高亲和力p97的称为ASPL的蛋白质。与p97一样,ASPL是蜂窝废物处理的一个组成部分。经过仔细观察,结果发现ASPL将p97打破了它的子单元:“p97的六个亚基对彼此有很大的吸引力。我原本以为破坏这种稳定的蛋白质复合物会非常困难或根本不可能”。 Arumughan说。
为了更好地理解ASPL对p97的影响,Arumughan和他的同事们研究了结合配偶体的三维结构。他们发现了两个p97和ASPL分子的四聚体复合物,而不是六个亚基的环状结构。
在进一步的实验中,Arumughan确定了可以破坏p97六聚体的ASPL部分。研究人员将ASPL蛋白质修剪成一个部分,该部分也以类似的形式存在于许多其他蛋白质中。该片段称为“UBX”,通常识别并结合p97蛋白复合物。然而,在ASPL中,UBX模块不仅用于与p97对接,而且还将其分解为其子单元:“好像自然采用了已知的绑定图案,并且为了得到这个工作而附加了两个额外的手臂完成了,“Arumughan谈到了新发现的蛋白质片段,现在称为”扩展UBX“(eUBX)。
ASPL或其eUBX模块不能用作癌症治疗。分子很大,不能从外面渗入细胞。
然而,现在可能更容易找到较小的分子,其作用方式类似于ASPL。“我们的研究结果可以帮助其他人识别破坏p97结构的药物,就像ASPL一样”,小组负责人Erich Wanker说。但首先,研究人员希望了解新发现的p97 / ASPL复合物能够实现哪种细胞功能,因为这仍然是完全未知的。
推荐内容
-
新的CRISPR工具靶向哺乳动物细胞中的RNA
麻省理工学院和哈佛大学广泛研究所的研究人员表明,基于CRISPR的编辑系统可以切割和结合哺乳动物细胞中的RNA。本周在自然杂志的一篇论文中
-
研究人员确定上皮复发性侵蚀营养不良的遗传原因
来自新西兰,澳大利亚和英国的国际科学家团队-包括利物浦大学的Colin Willoughby教授-确定了一个特定基因,该基因在上皮性复发性糜烂营养
-
在全国最大的水族馆中检测到的Planet最小的微生物
每年有超过200万人涌向乔治亚水族馆,观看由Home Depot建造的Ocean Voyager,这是美国最大的咸水栖息地,也是世界上最大的鱼类鲸鲨的栖息
-
基因组结构变异显示在改变DNA甲基化中起关键作用
由贝勒医学院的研究人员领导的一个多机构小组说,基因组结构变异是改变DNA甲基化的未知机制。他们在基因组生物学杂志中发表了他们的研究报
-
大象母亲和祖母的生殖和生存利益
只有少数哺乳动物和一些鸟类与人类一样长寿,并且这些物种中的许多物种在它们如何衰老方面具有有趣的特征。斯普林格的 行为生态学与社会生
-
科学家对亚洲梨基因组进行测序
由大学和机构组成的国际财团最近完成了亚洲梨基因组的首次测序。亚洲梨,也称为中国梨,韩国梨,日本梨,台湾梨和沙梨伊利诺伊大学农学...
-
关于germlines如何恢复活力的可能解释
加利福尼亚大学和卡利科生命科学学院的一对研究人员发现了关于人类种系如何恢复活力的可能解释。在他们发表在Nature杂志上的论文中,Adam
-
我们的DNA中隐藏的代码解释了如何制造新的基因片段
由于突变,我们都在这里。基因的随机变化是物种中多样性的变化,这使它能够适应新的环境并最终演变成全新的物种。但大多数随机突变实际...
-
12月15日辽宁大连疫情最新数据公布 辽宁省昨日无新增新冠肺炎
想必大家都知道,辽宁省,简称辽,取辽河流域永远安宁之意而得其名,是中华人民共和国省级行政区,省会沈阳。那么,你知道辽宁目前疫情...
-
巴拿马疾病真菌的路径首次建立
现在已经在缅甸发现了令人恐惧的Fusarium oxysporum土壤真菌热带种4菌株,该菌株在卡文迪什香蕉中引起巴拿马病。紧随其在越南和老挝的发现