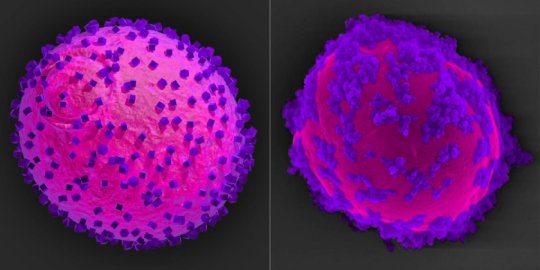
纳米容器将泰坦大小的基因疗法和药物运送到细胞中
约翰霍普金斯大学医学院的科学家报告说,他们已经创建了一个微型的纳米容器,该容器可以在细胞内滑动,并提供基于蛋白质的药物和任何大小的基因疗法-甚至是连接到名为CRISPR的基因编辑工具上的大型药物。如果他们的创造物-由可生物降解的聚合物构成-通过更多的实验室测试,则可以提供一种有效地将较大的药物化合物运送到特定选择的靶细胞中的方法。
研究小组负责人生物医学工程师约旦·格林博士说:“大多数药物以不分青红皂白的方式散布在整个人体中,而不针对特定的细胞。” “诸如抗体之类的某些药物会锁定细胞表面受体的靶标,但是我们没有将生物药物直接传递至细胞内部的良好系统,这是治疗方法最有可能正常工作的地方而且副作用更少。”
约翰·霍普金斯大学医学院的生物医学工程,眼科学,肿瘤学,神经外科,材料科学与工程,化学和生物分子工程学教授,成员格林表示,长期以来,许多学术和商业科学家一直在寻求更好的疗法治疗系统。约翰·霍普金斯大学彭博〜金梅尔癌症免疫疗法研究所的成员。
尽管这些传递系统的非感染性版本会释放出不需要的免疫系统反应,但一些可商购获得的技术会使用简化后的病毒形式-以直接“感染”细胞的能力而闻名。例如,其他针对患病血细胞的疗法则比较麻烦,需要先去除患者的血液,然后再用电流打开细胞膜上的孔来进入。
Green和他的团队在约翰·霍普金斯大学(Johns Hopkins)研发的纳米容器借鉴了病毒的特性,其中许多病毒的形状接近球形,并带有负电荷和正电荷。总体电荷更中性,病毒可以靠近细胞。对于许多生物药物而言,情况并非如此,它们由电荷高的大型蛋白质和易于排斥细胞的核酸组成。
为了克服这个问题,研究生袁锐开发了一种新型的可生物降解的高分子材料。聚合物是由许多分子组成的物质的总称。为了制造这种聚合物,Rui像一棵树的树枝一样串在一起,形成了四个组成分子,这些分子随着时间的流逝分解并溶解在水中。分子同时包含正电荷和负电荷。
具有正电荷和负电荷的平衡,分子根据其电荷推动和拉动,其氢原子与附近的生物疗法结合。结果是包含生物疗法的纳米结构。
纳米级容器的正电荷与细胞膜相互作用,并且该容器被吞入称为内体的细胞包装中。
进入纳米容器后,纳米容器会破裂并打开内体,聚合物降解,从而使药物在细胞内发挥作用。
为了测试他们的发明,Rui制造了一种小蛋白质的纳米容器,并将其喂入培养皿中的小鼠肾细胞。她在小蛋白质上附加了绿色荧光标签,并在大多数细胞中看到鲜绿色的飞溅,表明该蛋白质已成功递送。
然后,Rui包装了一种更大的蛋白质:人免疫球蛋白,一种通常用于增强免疫系统的疗法,以及一种抗体疗法的模型。这次,她发现接受治疗的90%的肾细胞被附着在免疫球蛋白上的绿色荧光标记点亮。
“当纳米粒子进入细胞时,它们通常被螯合到内体中,这会降解内含物,但是我们的实验表明蛋白质包装均匀地散布在大多数细胞中,并且没有卡在内体中,” Rui说。
为了更大的挑战,Rui创建了一个纳米包装,其中包含基于CRISPR的蛋白质和核酸复合物,当CRISPR化合物切割细胞基因组的一部分时,该复合物可能会关闭绿色荧光信号或使细胞发出红色光。研究人员发现,禁用基因的基因编辑在实验室中多达77%的细胞中起作用,并在约4%的细胞中添加或修复了该基因。
Rui说:“考虑到与其他基因编辑系统一起使用,您可能会在不到10%的时间内获得正确的基因切割结果,这是非常有效的。” 基于CRISPR的疗法具有精确靶向导致疾病的遗传缺陷的能力,因此有可能使药物更加精确。一些CRISPR疗法正在临床试验中进行测试。
在最后的实验中,Rui和她的同事们将脑癌细胞植入小鼠的大脑。她将具有基因编辑成分的纳米容器直接注入小鼠的大脑,并分析了它们的细胞是否发出红色光,表明基因编辑成功。她发现脑癌细胞从她注射的地方发红了几毫米。
瑞说:“五年前我刚开始这个项目时,科学家们认为您不能使用病毒以外的其他手段将这些疗法传递到细胞中。开发新技术可以帮助我们更多地了解疾病,而且有关制造新药的更多信息。”
Rui和Green试图使纳米容器更稳定,以便可以将它们注入血液中,并靶向具有某些遗传特征的细胞。
科学家们正在申请与这项工作有关的专利。
该研究的资金由国家科学基金会,约翰·霍普金斯大学医学院,美国国立卫生研究院(R01CA228133,R01EB022148和P30 EY001765),彭博·金梅尔癌症免疫疗法研究所以及约翰·霍普金斯大学提供。预防盲目James和Carole免费催化剂奖。
为这项工作做出贡献的其他科学家包括Johns Hopkins的David Wilson,John Choi,Mahita Varanasi,Katie Sanders,Johan Karlsson和Michael Lim。
推荐内容
-
用于酵母细胞生物工厂的太阳能电池板
基因工程微生物如细菌和酵母长期以来被用作生产工厂来生产药物和精细化学品。最近,研究人员开始将细菌与半导体技术结合起来,类似于屋...
-
单一锂离子通道聚合物粘合剂稳定硫阴极
电动汽车和人工智能等新兴技术对高性能储能系统的需求不断增长,推动了高性能电池的发展。作为下一代电池的有希望的候选者,Li-S电池以其高
-
新的转基因棉花禁用了吮吸白蛉
来自印度众多机构的一组研究人员开发了一种转基因棉花品种,可以阻止啄食的粉虱生长,减少对作物产量的负面影响。在他们发表在 自然生物技
-
自私基因既是毒药又是解毒剂可以消除竞争
来自Stowers医学研究所的研究人员与Fred Hutchinson癌症研究中心的研究人员合作,已经确定了一种前所未有的遗传生存策略,这种策略在Agath
-
如何接纳不完美的自己?
晚上翻来覆去睡不着的人,不是有心事,就是有故事。每个人都有睡不着的时候,不是不困,而是想的太多。失眠不是不困,而是心力交瘁。你...
-
2022年春节返乡最新政策回家要隔离吗?2022各地返乡隔离最新政策梳理
众所周知,元旦、春节将至,12月15日,健康时报记者致电多地疫情防控指挥中心,结合部分已发布的返乡政策梳理发现,全国31省市均建议所在地
-
成像单细胞以Usain Bolt的速度行进
近年来,通过基于微流体的流式细胞术的开发,已经大大改善了单细胞可以被分析和操作的精确度和准确度。尽管其灵敏度,但微流体流式细胞...
-
科学家对加利福尼亚双斑八爪鱼的基因组进行序列分析
来自日本和美国的一个国际遗传研究小组对加利福尼亚常见的双斑章鱼(Octopus bimaculoides)的基因组进行了测序和分析,使其成为有史以来第
-
发现了大脑的意志力
当健康的食客选择西兰花而不是蝴蝶结时,他们会在大脑中使用一个小区域,而这些区域是放纵者不使用的区域。一项新研究发现,这一系列细...
-
大象母亲和祖母的生殖和生存利益
只有少数哺乳动物和一些鸟类与人类一样长寿,并且这些物种中的许多物种在它们如何衰老方面具有有趣的特征。斯普林格的 行为生态学与社会生