在修复DNA的道路上的叉子
来自大阪大学的日本研究人员发现了一种细胞调节断裂DNA修复的方法。发表在Cell Reports杂志上的研究结果表明,一种常见的分子可以调节多种修复机制,并有助于阐明细胞在受损时如何维持人类基因组的完整性。人体由数万亿个细胞组成,每个细胞内都有数十亿个DNA分子。严格维持分子对于维持健康的细胞,从而维持健康的身体至关重要。
这种维护受到每日轰击化学物质,紫外线,自由基氧化物和可能损害DNA分子的辐射的挑战。如果未修复,则损害可能导致基因组不稳定和细胞死亡。值得庆幸的是,进化已经在细胞固有的修复机制中创造出来修复任何受损的DNA。
“细胞中的两种机制是非同源末端连接(NHEJ)和用于修复DNA双链断裂的同源重组(HR)”大阪大学研究生院教授Chikashi Obuse解释道。
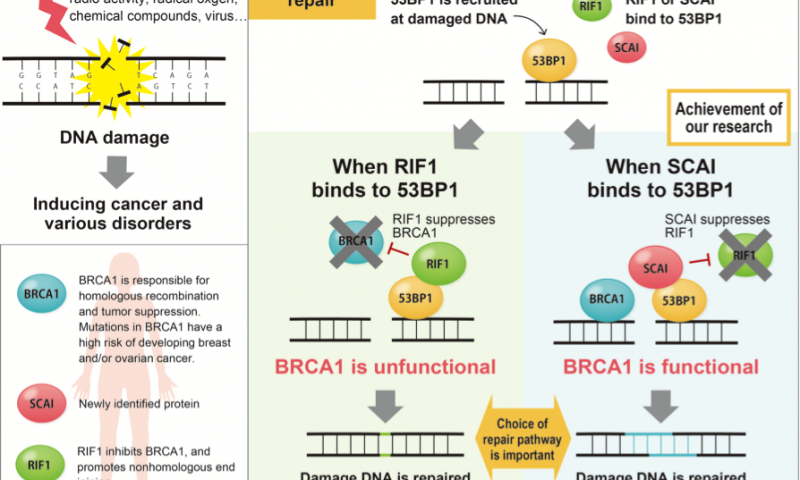
虽然NHEJ和HR都可以修复受损的DNA,但它们可以应对不同的情况; 损伤的类型,是否存在同源模板或细胞周期阶段等。研究人员继续躲避的是细胞如何知道要调用的系统。Obuse在他的最新报告中指出,癌细胞侵袭(SCAI)的蛋白抑制因子在HR的选择中起着重要作用。
为了研究SCAI的功能,Obuse和他的科学家团队将人体细胞暴露于X射线照射以破坏DNA。“我们的结果表明SCAI与53BP1结合,促进HR蛋白的募集。当我们耗尽SCAI时,这些蛋白质不会积累,”他说。
特别是,当SCAI耗尽时,Obuse强调了损伤部位蛋白质BRCA1的大量减少。另一方面,SCAI的存在抑制了另一种蛋白RIF1,以促进BRCA1的募集。“已知RIF1抑制DNA受损部位的BRCA1积累。它与53BP1结合。当我们观察细胞的共聚焦成像时,我们看到RIF1最初积聚在DNA损伤部位,但逐渐被SCAI取代,”Obuse说。
这导致科学家们想知道SCAI和RIF1是否竞争结合53BP1以及这种结合是否决定了DNA修复机制。
实际上,另外的实验显示53BP1的磷酸化状态决定了其结合配偶体。“对我们来说,下一个问题是确定哪些上游激酶负责磷酸化与SCAI结合所需的53BP1位点,”Obuse补充道。“上游信号分子对于帮助确定细胞对NHEJ或HR途径的选择非常重要。”
推荐内容
-
高压电线下真的不能打手机吗??真的假的?
随着互联网的快速发展,我们在获取信息的时候很容易被带跑方向。有时候真相也许并不是网上说的那样,所以我们必须要有自己的判断和独立...
-
全国高风险地区清零真的假的 全国中高风险地区最新名单
【 全国高风险区全部清零 !】从18日零时起:哈尔滨市利民开发区裕田街道调整为低风险、呼兰区建设路街道调整为低风险。此外, 全国仅剩中风
-
乳腺植入相关淋巴瘤至少与美国9例死亡有关
美国食品和药物管理局的设备中心周三表示,至少有9名死于全球癌症监管机构的美国患者与乳房植入物的联系日益密切。所述疾病不是乳腺癌,而
-
胡子会越刮越粗吗? 都来看看真实情况!
胡子会越刮越粗吗? 都来看看真实情况!全民自媒体时代,讯息传播效率飞速提高,但也出现了很多不实消息被误传的情况。因此我们在接受信息
-
懂事的夫妻!新人领证后第一时间给对方父母打电话 对话内容让人
新人领证后第一时间给对方父母打电话 对话内容让人直呼懂事。12月25日,湖南一对新人领完结婚证后,第一时间给对方父母打电话,对话内容曝
-
有袋动物的妈妈在牛奶中表达胎盘基因
现代母亲,无论是人类还是老鼠,都可能因嫉妒有袋动物而受到宽恕。在怀孕几天而不是几个月之后怀孕,而不是忍受长期怀孕和相对发育良好...
-
BMS收购并没有阻止Celgene与黑曜石的Kyn展开癌症合作
在被百时美施贵宝(Bristol-Myers Squibb)收购的过程中,Celgene继续寻求与癌症相关的合作,两家生物技术公司今天宣布了合作计划。Celgene