改进的阿尔茨海默氏症小鼠模型为精确治疗铺平了道路
许多转基因小鼠模型可以模拟一系列与阿尔茨海默病(AD)相关的病理。它们在AD潜在疗法的基础研究和临床前测试中都发挥着关键作用。尽管他们β-amyloid毒性的病理生理学,大大促进了人类疾病没有完全复制。

杰克逊实验室的一组研究人员试图验证将遗传多样性纳入AD小鼠模型将提高转译潜能的假设。研究人员指出,“个体的基因构成在决定AD易感性方面发挥着重要作用,但在临床前研究中很大程度上被忽视了。”他们将一个成熟的AD小鼠模型与一个基因多样化的参考小组结合起来,培育出具有相同高风险人类突变、但基因组其余部分存在差异的小鼠。遗传多样性的结合导致了与这种普遍的人类疾病的遗传、分子和临床特征的更大重叠。
这项研究发表在12月27日的《神经元》(Neuron)杂志上,题为《利用遗传复杂性提高阿尔茨海默氏症小鼠模型的可译性:精准医学之路》(驾驭遗传复杂性提高阿尔茨海默氏症小鼠模型的可译性:精准医学之路》)。
“这是第一次研究证明你可以复制很多阿尔茨海默病的分子特性的不同基因小鼠模型的“NIA主任理查德•j•赫德说。“它指向的策略更好地利用小鼠模型精度医学研究均基本和translational-for阿尔茨海默病。”
由杰克逊实验室副教授凯瑟琳·卡佐罗夫斯基博士领导的研究小组,将已建立的家族性AD (5XFAD)小鼠模型与一组基因多样化的小鼠组合在一起。因此,这一转基因小鼠家族的所有成员都携带高风险的人类家族性AD基因,但除此之外,它们的基因组成非常不同。对这组新小鼠(统称AD- bxd)的详细分析显示,与AD的遗传、分子、病理和认知特征有高度重叠。此外,在存在相同AD危险基因的情况下,遗传背景的差异导致AD病理和认知症状的发病和严重程度存在深刻差异。
通过一系列的对比分析,研究小组还发现,一种常用来产生AD转基因小鼠模型的小鼠品系C57BL/6J,具有一定的弹性因子,可以减轻AD风险因子基因的影响。这项新发现有两个重要意义。首先,提示具有这种遗传背景的AD小鼠模型可能不适合检测新的治疗药物,这可能解释了目前使用AD转基因小鼠模型进行药物筛选研究的预测能力较差。其次,利用AD- bxd面板,可以准确识别C57BL/6J菌株的保护基因及其机制,为AD预防提供新的候选靶点。
作者指出,AD- bxd小组代表了一种新的工具,可以更好地理解正常衰老和AD的异质性本质,并准确识别导致对遗传和环境疾病风险因素的恢复力的分子因素。
”的能力模型的遗传多样性及其对疾病风险的多个方面的影响和弹性在转基因小鼠健壮且可再生的方式将使研究团体学习更多关于阿尔茨海默氏症的复杂本质快得多,”说Suzana Petanceska,博士,NIA的神经科学分工,项目负责人负责Resilience-AD计划。“这一新的资源为NIA/NIH的一系列新项目增加了数据、分析和研究工具,从而使阿尔茨海默病的药物开发更加有效和具有预测性。”
作者不仅证明了遗传变异深刻地改变了人类AD突变对认知和病理表型的影响,而且证明了这种复杂的AD模型与人类AD具有高度的遗传、转录和表型重叠。他们引入了一种新的AD小鼠群体,作为研究AD潜在机制的创新和可复制资源,并提供证据表明,结合遗传多样性的临床前模型可能更好地转化为人类疾病,提高其在AD精准医学研究中的可用性。
阿尔茨海默病是一种不可逆的、进行性的大脑疾病,它会慢慢地破坏记忆和思考能力,并最终破坏完成简单任务的能力。据估计,多达550万65岁以上的美国人患有阿尔茨海默病,这是最常见的痴呆症。
Kaczorowski博士的团队是10个多学科、多机构的研究团队之一,这些研究团队通过弹性广告项目得到了支持,这是美国国家航空航天局支持的一系列开放科学联盟之一。弹性广告于2017年推出,旨在解决为什么以及如何让一些人在罹患AD的遗传或生物标志物风险很高的情况下仍然没有痴呆的问题。该项目旨在对遗传和环境因素如何相互作用以及如何导致AD高危人群的认知弹性产生更深层次的机制理解,并为药物和非药物预防策略确定新的治疗靶点。
推荐内容
-
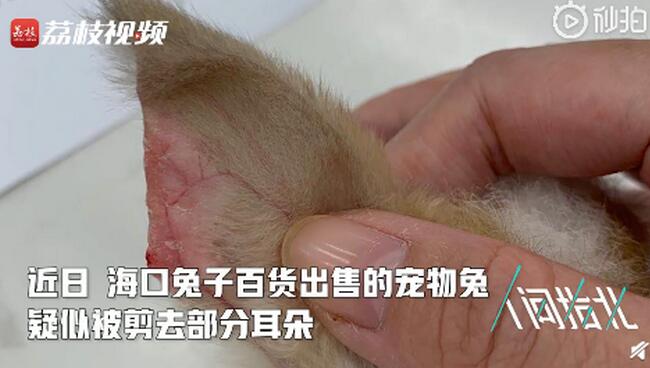
宠物店回应为抬价剪兔耳 看了真是让人触目惊心
【宠物店回应为抬价剪兔耳 看了真是让人触目惊心】这是要有多麽残忍的心,才能对于这种小动物下次毒手,小编看了就很心痛。近日,海口兔子
-
“钟南山院士前往成都抗疫”为假消息? 还真不一定!
“钟南山院士前往成都抗疫”为假消息? 还真不一定!随着互联网时代的到来,信息传播速度越来越快,但其中很多消息还没被证实真实性就...
-
“桃养人,杏伤人” 这种说法真的有科学依据吗?来看学者的建议
互联网时代,每个人都是信息传播者,但是我们必须清楚一点:在没有获得真正证实的消息之前,千万不能随意散播谣言,很容易造成以讹传讹...
-
11月11日大连沈阳疫情最新数据公布 辽宁昨日新增21例本土确诊病例
辽宁新增21例本土确诊病例 新增16例本土无症状感染者。据消息显示,11月10日0时至24时,辽宁省新增21例本土新冠肺炎确诊病例(其中6例为无
-
必须辟谣!关于茶叶的这些流言都是假的,很多人还信以为真…?实
面对流言,希望我们第一时间想到的是寻找官方回应。而不是着急着把流言传播出去,毕竟现在网络相关的法律法规都出台了,网络上传播谣言...
-
RNA变化辅助向日葵的快速进化的转换
Boulder-led科罗拉多大学一项新的研究揭示了遗传机制,允许向日葵经历一个相对快速的进化从野生驯化在短短5000年。向日葵,对于它们的种子和
-
中暑后喝藿香正气水?具体什么情况呢
互联网时代,每个人都是信息传播者,但是我们必须清楚一点:在没有获得真正证实的消息之前,千万不能随意散播谣言,很容易造成以讹传讹...