FDA解除了对Sarepta DMD基因治疗候选表皮酶癌的控制
FDA已经取消了4月份对Epizyme癌症治疗药物tazemetostat的部分临床禁药,以及7月份对Sarepta Therapeutics公司Duchenne肌营养不良(DMD)基因治疗候选药物AAVrh74.MHCK7的I/IIa期临床禁药。这些公司说,微营养不良。
FDA暂停了在美国的注册在一项一期儿科研究(NCT02601937)中,一名患者出现了t淋巴细胞淋巴瘤(T-LBL)。
病人”先进低分化脊索瘤”,是唯一实例tazemetostat所观察到的继发性淋巴瘤的临床程序,Epizyme实施部分持有时表示:“当时的安全报告,病人已经研究了大约15个月,取得确认部分反应。这个病人现在已经停止使用他齐美司他,正在接受t细胞淋巴瘤的治疗。
今天,Epizyme表示,根据已发表的文献和公司迄今的临床经验,该公司对T-LBL患者进行了跟踪调查,并向FDA提交了一份正式回应,其中包括对继发性恶性肿瘤风险的全面评估,包括T-LBL可能与tazemetostat有关。
Epizyme表示,它对其在成人和儿童血液系统恶性肿瘤和实体瘤的所有试验中的有效性和安全性数据进行了全面评估,并召集了一个外部科学和医学专家小组,对这些发现进行了审查和验证。
重新注册
此外,Epizyme说,它正在重新开放在美国所有由该公司赞助的试验的注册包括滤泡淋巴瘤(FL) EZH2激活突变队列的II期非霍奇金淋巴瘤试验。
“Epizyme团队一直在努力向FDA提供全面的回应,通过建设性的对话,我们成功地解决了部分临床问题。”Epizyme总裁兼首席执行官Robert Bazemore在一份声明中说:“这使我们能够将我们的全部注意力转移到我们的主要优先事项上:准备我们在上皮样肉瘤中首次提交tazemetostat的NDA申请,并确定我们在FL中的注册路径。”
Tazemetostat first-in-class增强剂的zeste同族体2(EZH2)抑制剂研究作为单一疗法在正在进行的二期项目实体肿瘤,包括上皮样肉瘤和其他INI1-negative肿瘤,和滤泡淋巴瘤(FL)以及结合研究弥漫型大b细胞淋巴瘤(DLBCL)和非小细胞肺癌(NSCLC)。
根据Clinicaltrias.gov网站,tazemetostat正在7项招募患者的积极研究中进行评估;其他五项研究都很活跃但没有招募病人;三项研究在最近的更新中被暂停。
暂停:
国家癌症研究所(NCI)一期试验(NCT03217253)旨在评估tazemetostat治疗实体瘤或b细胞淋巴瘤患者的最佳剂量和副作用,这些患者伴有肝功能障碍,已扩散到体内其他部位或无法通过手术切除。(7月18日暂停)。
二期NCI儿科匹配试验(NCT03213665)旨在研究如何tazemetostat作品在治疗实体肿瘤的患者,非霍奇金淋巴瘤,或组织细胞的疾病已经扩散到身体的其他地方,回来还是没有回应治疗和EZH2, SMARCB1或SMARCA4基因突变。
由Epizyme和淋巴瘤学术研究组织进行的I/II期试验(NCT02889523)。第一阶段的目的是确定的推荐剂量二期tazemetostat R-CHOP 21化疗患者,而第二阶段的目的是确定的安全tazemetostat R-CHOP 21日在患者8周期以及完全缓解率根据Cheson国际工作组(IWG)2014:8个周期后卢加诺分类Epi-RCHOP 21。
“Trace”触发Sarepta Hold
AAVrh74.MHCK7的Sarepta一期/IIa试验(NCT03375164)。在一家未公开的第三方制造商提供的大量研究级原料质粒中发现“微量”DNA片段后,微营养不良蛋白被临床搁置。
今天,Sarepta表示,在与临床试验伙伴全国儿童医院(Nationwide Children’s Hospital)合作,制定并向FDA提交一份行动计划(包括对质粒供应商进行审计,并承诺在未来所有生产批次中使用GMP-s质粒)后,其临床控制地位被解除。
“感谢我的勤奋和快速工作Sarepta同事和全国儿童医院的编译和提交一个完整的反应,迅速被FDA评估回顾响应和删除这个临床,我们已经能够解决临床及时在记录时间和这个极其重要的临床程序,“Sarepta总裁兼首席执行官Doug英格拉姆说。
英格拉姆补充说:“我们现在的重点是与[FDA]会面,就我们希望的微营养不良蛋白项目的注册试验进行指导并取得一致意见,并实现到2018年底开始试验的目标。”
该试验是AAVrh74.MHCK7的两项临床研究之一。微营养不良素列于ClinicalTrials.gov。全国儿童基金会也在监督一期双盲随机对照研究(NCT02710500),评估基因疗法作为一种治疗异常铁蛋白病的方法,直接肌肉注射raavr .74. mhck7 . dysf。DV基因载体到指短伸肌(EDB)。在7月18日发布的最新更新中,该试验是积极的,但没有招募患者。
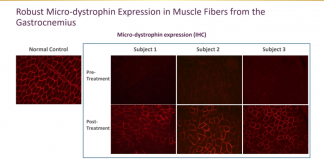
一个月前的6月19日,Sarepta宣布AAVrh74.MHCK7的初步临床数据为阳性。I/IIa期研究中的微营养不良蛋白。Sarepta宣布,三例患者在各种方法测量的肌肉中均表现出较强的微肌营养不良蛋白表达,血清肌酸激酶(CK)水平显著下降,CK是一种与DMD引起的肌肉损伤密切相关的酶生物标志物。第60天CK平均下降87%以上。
推荐内容
-
在某些景观中 这是对抗捕食性细菌的有效策略
掠食者和猎物可以在生命树中找到,甚至可以在细菌中找到。Bdellovibrio bacteriovorus是一种这样的细菌捕食者,是普遍存在的大肠杆菌细菌
-
船形膜蛋白为在细胞膜中工作提供了新颖的解决方案
St Jude儿童研究医院的科学家已经发现了一种新型结构,它可以帮助酶通过像细胞膜表面的船一样摆动来解决具有挑战性的生物学问题。这一发
-
成为妈妈从不容易,但她们却选择“为爱而生”
成为妈妈从不容易,但她们却选择“为爱而生” 编者按:在肿瘤越来越高发和年轻化的今天,成为妈妈对部分女性而言开始变得没那么容...
-
早期植物谱系的基因组分析揭示了植物如何在陆地上茁壮成长
虽然它在世界各地都有发现,但很容易忽视常见的地钱 - 植物可以放在手掌中,看起来由平坦,重叠的叶子组成。尽管这些植物没有令人难以置
-
江西4月20日前不进行养老资格认证就停发退休工资? 来看专业人士
江西4月20日前不进行养老资格认证就停发退休工资? 来看专业人士解答全民自媒体时代,信息被大众获取的途径多种多样,但也出现了很多不实





