在小鼠中单一疫苗促使免疫系统对抗乳腺癌肺癌和皮肤癌
在再生医学领域,诱导多能干细胞在其袖子上有很多巧妙的技巧。其中一人可能正在教导免疫系统如何击退癌症。在研究中,可以在领域的青年打开一个新的前沿的癌症免疫疗法,斯坦福大学的科学家们发现,接种小鼠与干细胞已经被灭活通过辐射显著提高动物的防御反对乳房,肺和皮肤癌。
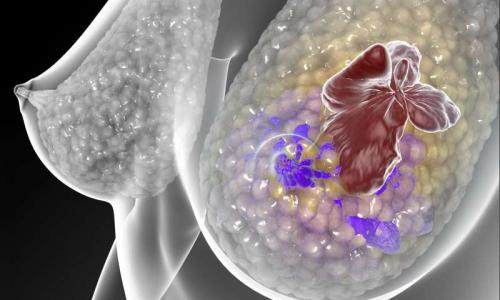
当与已经在人类中使用的免疫增强剂一起施用时,灭活干细胞的疫苗可以防止癌症在已经手术切除肿瘤的小鼠中复发和扩散。
显示出这种希望的疫苗是用从小鼠取得的正常皮肤或血细胞制成的,然后当它们有可能成为许多不同种类的细胞时重新编程为它们的原始形式。
基于这些诱导的多能干细胞或iPSC的疫苗最多只能实现多年,并且从长远来看可能永远不会成功。
但如果确实如此,它可以预防性地用于由于其基因构成或其冒险行为(例如吸烟)而患癌症的高风险患者。或者,在肿瘤失控的生长被手术,化学疗法或放射线破坏后,它可能会被施用于癌症患者。
该研究于周四在Cell Stem Cell杂志上发表。
在重编程干细胞必须以辐射的爆炸被灭活,他们可以在疫苗使用前。这一关键步骤降低了一旦进入体内,它们就会肆虐并导致肿瘤的风险。
纽约伊坎医学院癌症研究员Eirini Papapetrou博士称这项研究的结果“非常了不起”。
Papapetrou表示,对小鼠进行的一项研究与证明这种疫苗可以保护人类免于癌症相去甚远,而Papapetrou没有参与这项研究。她补充说,研究人员的目的是将他们的发现转化为人类治疗,他们必须证明灭活的干细胞是安全的。
Papapetrou表示,即使斯坦福大学的工作不能生产单一的干细胞疫苗,它也可以确定更好的免疫增强癌症药物靶标。这可能会使一类新的抗癌药物CAR-T免疫疗法更有效。
在作者描述的第一个实验中,实验室小鼠在研究人员注射小鼠乳腺癌细胞之前接受了iPSC疫苗的变体。一周后,所有小鼠都出现了肿瘤。但接种干细胞和免疫增强剂的动物中有70%在四周内完全清除了肿瘤。其余30%的肿瘤明显小于接种乳腺癌细胞的小鼠,但未接种疫苗。
在第二个实验中,研究人员用iPSC疫苗接种小鼠,然后给他们注射间皮瘤细胞,这是一种肺癌。与没有接种疫苗的小鼠相比,那些获得干细胞和免疫增强剂混合物的小鼠可以有效抵抗癌症。在免疫反应最强且最狭隘地集中于肿瘤的小鼠中,肺癌最不可能保持和生长。
使用皮肤癌细胞的第三个实验证明,在通过手术切除现有肿瘤后,iPSC疫苗可用于预防癌症复发或转移。
对于这个实验,研究人员用黑素瘤细胞感染小鼠;肿瘤出现后,他们进行手术切除。在那时,一些小鼠获得了具有免疫增强剂的iPSC疫苗,并且一些只获得了免疫增强剂。
手术后未接受任何治疗的小鼠看到手术部位周围的黑色素瘤迅速恢复,以及远离原始肿瘤的转移灶的出现。获得免疫增强剂的小鼠仅维持其无肿瘤手术部位,但遭受远处转移。同时获得干细胞和免疫增强剂的小鼠在手术部位附近或远处都没有肿瘤复发。
干细胞如何教导免疫系统对抗癌症?
因为多能干细胞有可能产生大多数任何类型的细胞,它们也在其中携带癌症的种子。事实上,自我更新的特质使它们如此有希望作为再生医学治疗也使它们有可能引起肿瘤。
最原始形式的干细胞具有与癌症的亲缘关系的外在迹象。数百种独特的蛋白质称为抗原的小片段在其表面上表达,其中许多片段看起来就像癌细胞表达的一些表面蛋白质。
对于斯坦福大学的医生和细胞生物学家Joseph Wu和Nigel G. Kooreman来说,这种外在的形象似乎是免疫系统的教学机会,并且有机会为迅速发展的癌症免疫疗法领域增添一些火力。
他们推测,如果免疫系统经过训练可以识别干细胞上的许多蛋白质,那么当它遇到癌细胞时,它会获得一个目标库。
这将是一种比CAR-T免疫疗法使用的方法更不具针对性的方法。但吴和Kooreman认为,这可能会更加强大。
在CAR-T治疗中,医生收获一些患者的免疫系统T细胞。然后,他们通过基因工程将这些防御战士安置在患者自身癌症表面发现的少量靶蛋白上。最后,这些新训练的T细胞的数量成倍增加并返回给患者以对抗该癌症。
但是,CAR-T的有效性取决于科学家们对免疫系统的一些优秀目标的选择。如果他们受到攻击训练的表面蛋白质不是正确的目标,或者如果癌细胞找到了从免疫系统中掩盖这些蛋白质的方法,那么它们将无法发挥作用。
也许显示免疫系统患者自身干细胞表面的所有蛋白质都会给它提供一大堆目标,帮助它找到并杀死癌细胞。如果一种目标蛋白质不正确,那么另一种蛋白质就是。
经过多年研究干细胞,吴说他“永远无法回答癌细胞表面的哪种抗原”将成为免疫细胞的最佳信标。最后,他说,“我们可能不必”确定哪些最有效。
“这些细胞表面有数百种与肿瘤相关的抗原 -甚至数千只,”吴说。“有可能我们甚至都不知道。”
推荐内容
-
Tardigrades使用独特的蛋白质来保护自己免受干燥
Tardigrades是一种微型动物,也被称为水熊和苔藓仔猪,由于它们具有类似Muppet的外观和能够在极端环境中生存的能够摧毁大多数其他生物的能
-
用生理盐水假冒新冠疫苗? 确有其事?
用生理盐水假冒新冠疫苗? 确有其事?随着网络时代的快速发展,大众获取消息的渠道非常多,但也出现了很多不实消息被误传的情况。所以在获
-
世界上第一台用于观察4-D癌细胞的光学仪器
一种新的光学仪器可以帮助科学家观察4-D中的活细胞,并了解是什么触发它们在人体周围发生变异和传播疾病,已经获得了近100万英镑的资金。由
-
外来物种入侵仍在上升
根据UCL的一项新研究,地球上所有物种中有多达16%可能成为潜在的外来物种,如果它们入侵新地区,影响将很难预测。该研究表明,新出现的外来
-
弯曲杆菌使用其他生物体作为特洛伊木马来感染新宿主
金斯顿大学的研究人员已经证明了细菌性食物中毒的主要原因是如何繁殖和扩散 - 通过使用另一种生物体的细胞作为特洛伊木马。空肠弯曲菌(Ca
-
紧急提醒!不要食用!不要食用!
紧急提醒!不要食用!不要食用! 每年随着夏天雨水开始充沛起来树林间、草坪里一大波蘑菇开始探头探脑了……重要提醒!看起来美味...
-
花粉基因仅在一些玉米品种中自然突变
根据有助于解释某些菌株遗传不稳定性的研究,花粉基因仅在某些玉米品种中自然突变,可能导致玉米和其他作物更好的繁殖。根据Rutgers领导的
-
牙膏可以刷去幽门螺杆菌吗?大家都来看看
日常生活中我们经常会听到各种各样的坊间流言。然而很少人去求证这些流言的真实性,久而久之就变成了真事。在这里,小编必须提醒大家,...