通过极端显微镜揭示酵母膜中的岛屿
格罗宁根大学的微生物学家已经可视化了面包酵母细胞膜上的小岛。这些膜隔室似乎在使用前储存转运蛋白。科学家观察到这些蛋白质在酵母的质膜中移动得非常缓慢,并发现它们如何穿过膜进入岛屿。他们使用最先进的超分辨率光学显微镜进行了这些观察。结果于2月5日在Nature Communications上发表。
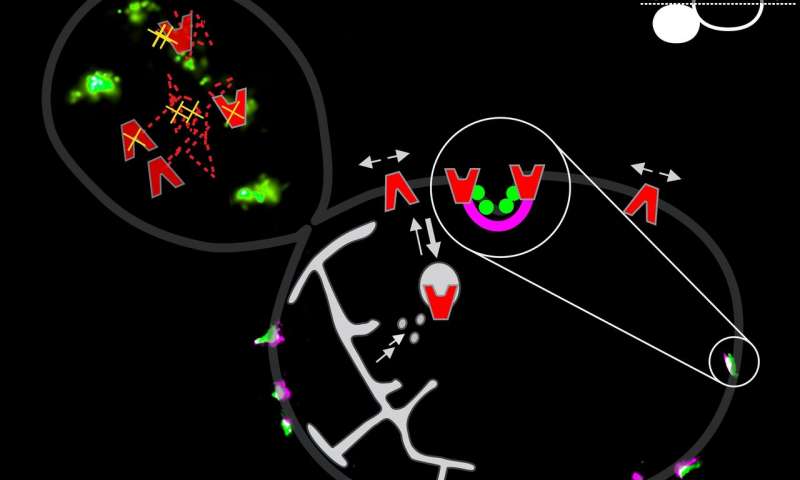
直到大约10年前,关于细胞生物学的教科书将细胞膜显示为具有随机插入的膜蛋白的同质脂质双层。但是,这种观点有不同阶段的哺乳动物细胞膜发现显著改变细胞。脂质组合物在膜上的“岛”上可以不同,这影响蛋白质分布。然而,关于酵母细胞中的类似结构知之甚少。
“20世纪60年代后期的电子显微镜研究显示酵母膜中存在凹陷,但它们没有详细研究,因此被视为样品制备的假象,”格罗宁根大学生物化学教授Bert Poolman解释道。“然后,大约10年前,这些萧条被重新发现。科学家观察到附着在膜内侧的香蕉形蛋白质,这些蛋白质被证明是造成这些洼地的原因。”
Poolman决定研究酵母膜中的这些凹陷有多种原因。“我们深入参与了一个用分子成分构建合成细胞的项目。所以我们需要了解很多关于膜以及如何掌握膜蛋白的知识。”此外,eisosomes是Poolman研究小组的行业合作伙伴感兴趣的许多转运蛋白的优先位置。
转运
通过使用不同的荧光标记物来标记膜中的转运蛋白和内侧的香蕉形蛋白,Poolman小组确定哪些蛋白质与eisosomes共定位。由于凹陷仅约50纳米深,并且异构体的尺寸最大为150×100纳米,因此需要极高的分辨率。“幸运的是,我们的实验室拥有一套专用显微镜,可以获得如此极高的分辨率,并结合观察活细胞中单个分子所需的高灵敏度。”超分辨率显微镜的经验和膜生物化学方面的专业知识使该组能够提供所需分辨率的图像。
研究表明,一些氨基酸转运蛋白优先定位于eisosome中。“但只有当没有可用的底物时,”Poolman解释道。“如果我们添加正确的氨基酸,蛋白质就会从eisosome移开,可能是因为它在底物结合状态下呈现出不同的构象。”他的假设是,eisosomes保护转运蛋白免于回收。“蛋白质在细胞中合成,然后通过胞吐作用转运到细胞膜上。但是,当它们不在eisosome中时,这些蛋白质会通过内吞作用迅速被吸收。”因此转运蛋白被瞬时“储存”在eisosomes中。当细胞外存在适当的底物时,
扩散
并非所有蛋白质都存在于eisosomes中。Poolman说:“例如,我们注意到具有大细胞内结构域的膜蛋白不能进入它们。”他们提出,膜内侧的香蕉形蛋白质阻碍了细胞内结构域,阻碍了它们向细胞体的扩散。
Poolman小组还评估了蛋白质在酵母质膜中扩散的速度。他们观察到这比哺乳动物细胞或酵母细胞内膜低约一千倍。“酵母质膜更坚硬。它可以承受相对高浓度的酒精或酸。这显然会影响蛋白质的扩散。”
该研究的结果提供了对酵母细胞膜的功能的更好的了解,更具体地是对于eisosome岛。他们还提供有关膜转运蛋白的生物发生和运输的新信息,这些信息及时可以提高酵母的工业生产力。
推荐内容
-
彭浦新村、昌里路等上榜“上海摆摊夜市分布图”? 来看专业人士
彭浦新村、昌里路等上榜“上海摆摊夜市分布图”? 来看专业人士解答信息时代的来临,大众获取消息的渠道非常多,但其中很多消息还没被...
-
成纤维细胞亚群帮助癌症逃避免疫系统
胰腺导管腺癌(PDAC)是世界上癌症相关死亡的第四大原因。由于它主要是化学抗性,PDAC到目前为止还没有有效的治疗方法。了解围绕,培养甚至保
-
喝高度白酒、蒸桑拿,可以抵抗新型冠状病毒?你了解多少
面对流言,希望我们第一时间想到的是寻找官方回应。而不是着急着把流言传播出去,毕竟现在网络相关的法律法规都出台了,网络上传播谣言...
-
扁豆会损害肝脏,不能吃? 这才是事实!
扁豆会损害肝脏,不能吃? 这才是事实!随着网络时代的快速发展,讯息传播效率飞速提高,但其中很多消息还没被证实真实性就大范围传播开了
-
2019让这些健康谣言失去生存土壤? 真的是这样吗?
2019让这些健康谣言失去生存土壤? 真的是这样吗?全民自媒体时代,信息传播速度越来越快,但其中很多消息还没被证实真实性就大范围传播开
-
喝姜枣茶包治百病?具体什么情况呢
当我们不知道一件事真假的时候,不防多等等官方的回应。因为信息碎片化,很多小伙伴现在上网很容易只看到事情的一面就下定论,其实很多...
-
俄罗斯研究人员宣布计划创建更多CRISPR编辑的婴儿
一位俄罗斯研究人员宣布了创建基因编辑婴儿的有争议的计划,称他拥有这样做的技能和技术,并且如果他能获得批准,他将继续前进。莫斯科Piro
-
想靠手环驱蚊? 别困惑,这里有答案!
想靠手环驱蚊? 别困惑,这里有答案!流量为王的时代,消息的传播方式多种多样,但也出现了很多不实消息被误传的情况。所以在获取信息的时