使用表面等离子体共振来改善抗体检测和表征
当研究人员谈论抗体时,他们想知道的第一件事就是抗体与其靶标的结合程度 - 换句话说,它是多么具体。在商业研究公司Frost and Sullivan为The Scientist进行的实验室抗体使用调查中, 84%的受访者表示测量抗体特异性对他们的研究非常重要。
在实验室中使用抗体
了解The Scientist的读者最喜欢哪些抗体供应商,以及市场研究公司Frost&Sullivan的调查结果。
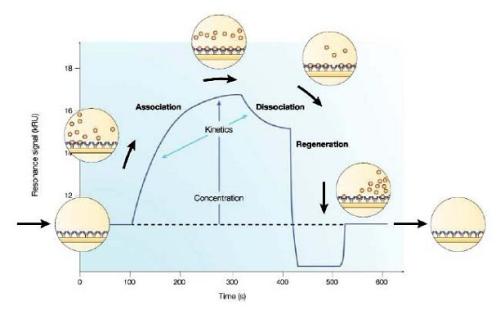
对于抗体特异性的表征,使用表面等离子体共振(SPR)的无标记检测系统是王道。与ELISA或基于荧光的技术不同,这些系统可以实时测量抗体和抗原以及其他结合配偶体(例如DNA和脂质)的结合和解离。因此,人们可以以非常快速的开启和关闭速率研究抗体相互作用,从而研究低亲和力。
“SPR技术作为一个整体,特别是Biacore,在灵敏度和通量方面具有最多选择,”Regeneron Pharmaceuticals的科学家Matthew Blome说,他专门研究SPR和其他无标记相互作用分析方法。
SPR在20世纪90年代初期以商业领域的形式出现,由GE医疗集团生产的Biacore作为最常用的品牌。该仪器通过固定相互作用对中的一个成员来工作,称为基质 - 在某些情况下是抗体 - 在薄金属片上,通常是金。然后将样品或目标蛋白质以不同浓度的溶液流过片材。仪器将光线照射到表面上,并根据光线反弹的角度测量其折射率(RI)。RI值根据芯片上分子的质量而变化:当样品结合底物时RI增加,而当样品解离时RI返回基线。结合和解离的速率以及因此结合的动力学和抗体亲和力可以从RI随时间的变化图计算。
Blome说,SPR仪器,以及研究人员对如何使用该技术的理解,近年来已经走过了漫长的道路。 科学家与专家讨论了他们如何使用SPR来收集抗体结合的见解,同时克服实验挑战。
Irwin Chaiken,德雷塞尔大学医学院生物化学与分子生物学教授
项目
确定一种名为m18的HIV抗体是否通过与病毒包膜蛋白gp120上的相同表位结合来阻断HIV感染,CD4受体是CD4受体,该病毒用于进入(宿主)T细胞。
问题
通常,人们可能会将gp120粘附到金属表面并在其上面流过CD4,然后用m18来分析m18是否与CD4或不同的CD4结合到gp120蛋白上的相同位置。但SPR读数是分析物质量的函数,在这种情况下解释特别棘手,因为CD4和m18的大小相似。
解决方案
Syna Kuriakose Gift与合作者一起,在Chaiken实验室的研究生期间,通过将gp120和CD4预混合在一起,然后将混合物流过固定化的m18底物,使实验成为可能。因此,只有当CD4和m18在gp120上具有彼此远离的结合位点时,才会发生m18与gp120的结合。在2011年的一项研究中,研究小组发现gp120-CD4复合物未能结合锚定在芯片上的m18,这表明m18中和抗体可能通过与CD4竞争gp120结合而发挥作用。
使用多组分系统比使用双组分系统更难测量离解率。尽管预混合复合物在与配体结合期间可能保持完整,但它也可能在解离期间断裂。“它是两种解离现象的混合物,”Chaiken说。因此,您可以真正了解CD4和m18如何通过在双组分SPR实验中单独测试来比较它们对gp120的亲和力。
“蛋白质不是岩石,gp120绝对不是岩石,”Chaiken说。响应于与CD4的结合,gp120经历构象变化,其增加其对HIV T细胞共同受体CCR5的亲和力。在2011年的研究中,Chaiken的研究小组发现m18不会引发通常允许其进入细胞的gp120的重要构象变化,这解释了为什么抗体如此有效。
检测食品样品中的细菌污染
研究员
Richard O'Kennedy,都柏林城市大学生物科学教授
项目
开发一种基于SPR的快速诊断系统,用于检测不需要细菌培养的食品和饮料样品中的单核细胞增生李斯特菌,正如传统的生化和血清学测试所做的那样。
问题
从历史上看,使用SPR检测整个细菌细胞一直受到弱信号发射的困扰。部分挑战是底物抗体将其表位定位在高度异质的细胞表面上。
解决方案
通常使用“胶”将抗体固定在芯片上,所述“胶”使抗体定向并确保表位结合区在其流过芯片时面向样品。然而,O'Kennedy的研究小组发现,他们可以通过将其分子与长葡聚糖分子连接起来,使其李斯特菌抗体增强,使抗体更像是在溶液中移动,从而促进它们与难以到达的表位的结合,奥肯尼迪解释道。此外,该小组确定了理想的抗体密度,O'Kennedy说,必须通过实验确定每个结合对,以便含有多个相同抗原表位的细菌细胞可同时结合两种抗体,从而增加SPR信号。
挑战
全细胞大而且充电,因此存在可能堵塞SPR仪器中的管道的风险。O'Kennedy说,通常需要进行优化,例如降低分析物流过仪器的速度。他补充说,管道在Biacore模型之间有所不同。“Biacore 3000在检测SPR信号时更敏感,但Biacore 1000在使用较大细胞时可能更好,因为它具有较低的堵塞机会。”
改进的空间
在这种情况下,SPR需要能够对细菌的存在给出是或否的读数。在2006年的一项研究中,O'Kennedy的研究小组发现SPR可检测到的单核细胞增生李斯特菌的最低浓度为107个细胞/ mL。然而,根据目前的食品政策,SPR必须在25克食物中鉴定单个细菌,这将意味着将1毫升食物中的单个细菌提取到溶液中用于SPR分析。“我认为有可能达到更好的水平,”O'Kennedy说,通过进一步修改抗体如何与芯片表面结合并开发出对单核细胞增生李斯特菌具有更高亲和力的抗体。
ID'ING ANTIBODY BIOMARKERS
研究员
Richard Van Duyne,西北大学化学教授
项目
检测生物样本中的淀粉样蛋白-b低聚物 - 阿尔茨海默病的潜在诊断测试
问题
淀粉样-B的肽链,或ADDL的,其被认为在阿尔茨海默氏早期发挥作用,存在于非常低浓度-在飞摩尔范围(10 -15)在脑脊液和大约10 -18在血液摩尔,范杜恩说。但检测的抗体的极限是在皮摩尔范围(10 -12最好的SPR条件下)。
解
Van Duyne的研究小组开发了一种他们称之为局部SPR(LSPR)的方法,该方法利用纳米粒子来提高灵敏度。他们用三角形银纳米粒子涂覆硅酸盐芯片,从而产生强大的电磁场,改变可见光的波长,研究人员将其用作SPR读数。当在芯片上发生结合时,RI的变化影响电磁场并引起光波长的强烈变化。为了进一步放大信号,Van Duyne的小组用他们的LSPR进行了“夹心测定”方法。他们在纳米粒子包被的芯片上捕获实验室产生的ADDL抗体,然后将抗体暴露于来自阿尔茨海默病患者的脑脊液(CSF)样品,以允许样品中ADDL的结合。最后,他们允许第二个ADDL抗体结合ADDL以增强LSPR读数。Van Duyne说,当第二个抗体结合时,它可以提供最佳的质量增加,从而改变LSPR的读数。使用此设置,该组设法检测高飞摩尔范围内的ADDL。
挑战
因为LSPR的读数是波长而不是RI的变化,研究人员可以仅使用标准荧光显微镜和CCD检测器来检测折射光的波长,而不是SPR读数,这是基于光强度。根据Van Duyne的说法,一个缺点是纳米粒子涂层芯片和现成的LSPR仪器都没有商用:“没有公司可以在你做的时候握住你的手,而有SPR。”
改进:简化夹层
可以通过将ADDL固定为基板来简化LSPR设置,以允许添加不同的CSF样品而不牺牲灵敏度。在2011年的原理验证研究中,使用不同的靶蛋白和抗体,Van Duyne的研究小组表明,用第二种纳米粒子标记捕获抗体或样品抗体可将读数的灵敏度提高三个数量级。Van Duyne说,相同的设置可用于检测ADDL抗体的结合。
筛选高亲和力单克隆抗体
研究员
Terry Pearson,加拿大维多利亚大学生物化学和微生物学教授,以及SISCAPA Assay Technologies,Inc。的CSO,该公司使用抗肽抗体和质谱法测量生物标记物
项目
鉴定对生物混合物中低浓度存在的肽具有高结合亲和力的单克隆抗体。
问题
许多研究人员使用肽作为抗体结合底物,但这种方法充满了并发症。Pearson说,Y形抗体可以同时结合两种肽,可以人工增加几百倍的亲和力测量值。
解决方案
Pearson和他的同事通过将他们想要筛选的单克隆抗体固定在芯片而不是肽上来解决这个问题。这种情况没有亲合力或来自抗体二价的影响 - 因为尽管每种抗体仍然可以结合两种肽,但肽在溶液中并且因此可以彼此独立地缔合和解离。
挑战
通过结合小分子(如Pearson小组使用的1至2-kDa肽)获得良好的SPR读数比使用大分子(如抗体)获得良好的SPR读数更为棘手,因为SPR信号与质量直接相关。然而,保持SPR仪器清洁有助于他的团队获得可靠的,如果低,SPR信号,Pearson说。
改进:高通量筛选
为了鉴定可以检测稀有肽的高亲和力抗体,Pearson扩大了这种方法,以便他每天可以筛选40个兔单克隆抗体克隆。为了提高通量,Pearson的研究小组使用“捕获”抗体来阻断单克隆抗体。他将“捕获”抗体结合到芯片上,该芯片捕获了针对目标肽的第一个单克隆抗体。然后他将肽溶液流过芯片并测量RI以检查亲和力。每次实验后,研究小组都会简单地洗掉单克隆肽复合物以重复使用芯片。Pearson说,通过这种方式,每个芯片通常可以使用100次。
推荐内容
-
单细胞数据库来推动生物研究
怀特黑德研究所和麻省理工学院的一个小组利用单细胞技术分析了65000个细胞的再生真涡虫的扁形虫,Schmidtea mediterranea,揭示基因的活性物
-
非人类宿主与乍得和埃塞俄比亚的人分享几内亚蠕虫
Krisztian Magori总结了最近发表的关于从流行国家的人类和非人类宿主收集的几内亚蠕虫遗传结构的研究几内亚蠕虫Dracunculus medinensis(
-
2月28日哈尔滨疫情最新数据公布 哈尔滨昨日新增境外输入确诊
【摘要】非必要不外出、不出行、不远行。如果您28天内有境外或14天内有国内中高风险区的旅居史,请及时向社区报告。2022年2月27日0—24时,
-
又是一年吃虾季 口味虾要这样吃才健康
又是一年吃虾季 口味虾要这样吃才健康 吃口味虾的最佳季节到了!长沙的夜依旧热闹,夜幕降临的时候,街头巷尾满是吃虾的食客,尽管大
-
完善病毒包骡子
病毒并不总是坏事。事实上,科学家们可以利用某些病毒的能力来改善病毒携带药物分子。一种有用的病毒是豇豆花叶病毒(CPMV),一种可以被修饰
-
微信群有色情视频,群主和管理员将被行拘? 谁说的!
微信群有色情视频,群主和管理员将被行拘? 谁说的!信息时代的来临,大众获取消息的渠道非常多,但其中很多消息还没被证实真实性就大范围