FDA直接将Allergan Biocell乳房植入物与癌症风险联系起来
最近几个月,Allergan的纹理乳房植入物一直处于不断升级的安全丑闻的中心。加拿大卫生部及其法国同行在分析了BIA-ALCL病例后,于今年早些时候下令从各自的市场上拆除制药商的Biocell种植体。澳大利亚治疗用品管理局最近也提议禁止这些设备,周三是Allergan在监管机构做出最终决定之前做出回应的最后期限。
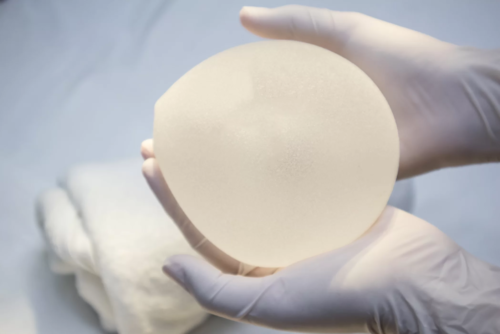
在整个监管行动浪潮中,FDA采取了比国际同行更为柔和的一致方式,并在5月份得出结论认为它不相信“该设备符合美国立法中规定的禁止标准”。 但周三,FDA宣布推出全球召回的 Biocell 种植体。
“虽然BIA-ALCL的整体发病率似乎相对较低,但一旦证据表明特定制造商的产品似乎与患者的重大伤害(包括死亡)直接相关,FDA就采取行动提醒公司注意新的证据。有必要召回以保护妇女的健康,“FDA主要副专员Amy Abernethy在一份声明中说。
“这令人震惊,”Breast Implant Victim Advocacy的创始人Jamee Cook说,他参加了FDA在3月举行的为期两天的设备咨询小组会议。“我们对结果非常欣喜,”她说。
“我的第一个倾向是:这不应该是自愿回忆,”她告诉MedTech Dive,并指出乳房植入物倡导界对FDA拒绝禁用这些设备的担忧。
但不管是什么促使FDA做出了决定,“这是一个很好的举措,它需要发生,”库克说,并补充说“肯定会拯救大多数处于危险中的女性”。
Stifel分析师在周三早上向Allergan投资者发表的一份报告中表示,美国仅使用纹理植入物占总手术量的10%左右,这可能意味着在2018财年美国乳房植入物收入的2.63亿美元中增加了2600万美元。
“虽然直接影响可以忽略不计,但间接影响可能更令人担忧,因为对平滑乳房植入物的需求可能会受到影响,诉讼索赔可能会增加,”分析师写道。
Allergan 表示,它正在启动全球自愿召回“作为预防措施,通知最新更新的全球安全信息,涉及[FDA]提供的[ BIA-ALCL ] 不常见的事件。”
Allergan 告诉医疗保健专业人员立即停止植入设备并退回任何未使用的产品。该行动仅影响Allergan的Biocell 产品。 Natrelle 光滑和Microcell 乳房植入物和组织扩张器将留在市场上。
美国食品和药物管理局表示,它没有建议删除这些设备,但建议与医疗保健提供商交谈。监管机构仍可考虑强制要求患者知情同意检查清单,并对乳房植入物发出黑匣子警告。
推荐内容
-
比盐和油更“可怕”,已被世卫组织封杀!出现这种字眼产品要少买
比盐和油更“可怕”,已被世卫组织封杀!出现这种字眼产品要少买 说到反式脂肪酸,大家肯定不陌生,生活中有许多常见食物富含反式...
-
国家卫健委回应核酸假阳性问题
国家卫健委回应核酸假阳性问题 中国日报5月23日电(记者 王小予)国家卫健委医政医管局监察专员郭燕红在今日举行的国务院联防联控机
-
首先了解裂谷热病毒中病毒丝的结构
圣安德鲁斯大学和格拉斯哥大学的研究人员在解决导致非洲频繁流行的病毒性疾病方面向前迈出了重要一步,并可能因全球变暖而蔓延到欧洲。...
-
李佳琦直播预告1.20 李佳琦2021.1.20年货节直播清单
李佳琦直播预告1 20,佳琦今晚会不会开播呢,美眉们想知道今晚佳琦卖什么吗,下面小编给大家带来李佳琦1 20年货节直播预告,一起来看看吧。
-
国内外GI标识情况?科学观点是说...
生活中我们经常会听见各种各样的流言,但是只要我们用心去思考和辨认其实 不难发现这些谣言有很多破绽。所以今天,小编照常给大家辟谣一则
-
乐陵市人民医院护理部郑育:“疫”路并肩,共迎春天
乐陵市人民医院护理部郑育:“疫”路并肩,共迎春天 寅虎之年,三月之初,疫情突发,3月10日晚,接到了紧急通知,去禹城执行支援任...