对DNA损伤位点过程的结构性见解
Ishan Deshpande和来自Susan Gasser小组的同事以及FMI的蛋白质结构设施阐明了Mec1-Ddc2(一种参与DNA损伤反应的肿瘤抑制因子)如何在DNA损伤部位聚集的机制。他们专注于Ddc2-RPA相互作用,它将Mec1-Ddc2激酶复合物带到DNA损伤位点的单链DNA上。凭借其结构数据,FMI科学家提供了两个先前发表的结构之间缺失的联系,允许他们在DNA损伤位点上的ssDNA-RPA上组装Mec1-Ddc2的大规模复合结构模型。
ATR激酶吸引了20多年的兴趣。该激酶是哺乳动物细胞中两种中心DNA损伤感应激酶之一,也是肿瘤抑制因子。两种抑制ATR激酶的化合物正在临床试验中用于治疗白血病和实体瘤。然而,这种酶如何在分子水平上受到调节仍然是难以捉摸的。
Ishan Deshpande是蛋白质结构设施的博士生和Friedrich Miescher生物医学研究所(FMI)的Susan Gasser小组,现在已经阐明了ATR,Mec1的酵母同源物如何在DNA损伤部位组装的机制用于特定于站点的激活。
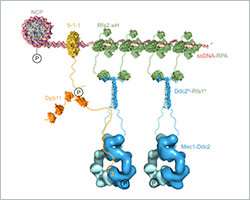
在酵母中,如在人类中,Mec1与称为Ddc2(人类中的ATRIP)的调节亚基形成复合物。在DNA损伤后,大片的单链DNA(ssDNA)被暴露,其被复制蛋白A(RPA)快速覆盖。Mec1-Ddc2识别这些ssDNA-RPA延伸并在这些位点累积以启动修复机制。
Deshpande及其同事现在已经解决了Ddc2 N末端的三维结构与RPA的一部分相关联,从而提供了RPA和Mec1之间关联的结构数据,这些数据到目前为止还难以捉摸。Deshpande解释说,我们获得了Ddc2 N末端的高分辨率共晶结构以及RPA的亚基。利用这些数据,我们可以证明Ddc2形成同源二聚体并通过其N末端结合RPA。有趣的是,我们的Ddc2-RPA结构是两个先前发表的结构之间缺失的链接,这使我们能够在DNA损伤位点上的ssDNA-RPA上组装Mec1-Ddc2的大规模复合结构模型。
Ddc2 N末端不仅促进Mec1与RPA的相互作用,而且还起Mec1激酶的间隔物的作用。Deshpande解释说:细长的Ddc2 N末端允许大的Mec1激酶模块移动而不会遇到受损的DNA,也不会在损伤处发生修复机械。此外,Ddc2间隔区可允许Mec1磷酸化多个空间上不同的底物,同时保持与DNA损伤位点结合。您可以将Ddc2 N末端视为长颈鹿的颈部,让长颈鹿能够到达地面上的草地以及高大树上的叶子。
适当的Mec1-Ddc2活性对于各种DNA损伤修复都很重要。然而,Deshpande及其同事的功能数据表明,Ddc2 N末端对紫外线DNA损伤后的细胞存活特别重要。Deshpande解释说,我们的模型表明仅仅将mec1-Ddc2募集到ssDNA可以促进其同源二聚化,从而激活Mec1-Ddc2复合物。
此外,Susan Gasser指出“这是我的实验室与FMI结构设施之间的精彩合作,使我们能够从结构到功能之间架起桥梁。”
推荐内容
-
胃肠蠕动功能差的人,尝试这5个方法进行调理,或能改善胃肠功能
胃肠蠕动功能差的人,尝试这5个方法进行调理,或能改善胃肠功能 在日常生活当中,有很多人经常会出现进食之后食物很难被快速消化,而
-
喝“千滚水”会造成亚硝酸盐中毒?看看真相是什么
生活中我们经常会听见各种各样的流言,但是只要我们用心去思考和辨认其实 不难发现这些谣言有很多破绽。所以今天,小编照常给大家辟谣一则
-
猎罪图鉴任晓玄被谁杀了凶手猜测 猎罪图鉴任的最大反派真凶
想必大家都知道,《猎罪图鉴》的叙事视角新颖又独特,以画像师的独特视角拨开了重重迷雾,再加上变幻莫测的场景以及扑朔迷离的案件,瞬...
-
推动癌症免疫治疗药物的开发
通过外媒资讯获悉,美国生物制药公司Checkmate Pharmaceucals近日任命Barry Labinger为公司总裁兼首席执行官,Checkmate创始人、原总裁兼
-
果蝇研究显示未探索的神经回路在调节记忆强度中的作用
学会避免负面体验需要两个不同的大脑回路的相互作用,一个解释Yikes!一项新的果蝇研究显示,并开始学习,另一方面,意外地说,要记住那种记
-
病毒特征可通过抗体治疗预测HIV治疗效果
事实证明,当前的HIV-1治疗在减缓病毒在体内的进程方面非常有效,且副作用极小。每日抗逆转录病毒疗法(ART)使用HIV-1药物的组合。但是,由
-
头脑转向的暴力行为可以帮助小型鸣禽杀死大型猎物
它们可能很小而且引人注目,但是伯劳鸟是以用尖锐的法案恶毒地刺杀受害者而闻名的鸣禽,尽管专家们长期以来一直想知道它们能够制服更大...
-
确定多发性硬化患者大脑中受影响的细胞类型
科学家们发现,被称为投射神经元的特定脑细胞在多发性硬化症(MS)中发现的大脑变化中起着重要作用。该研究表明,投射神经元受到身体自身免疫
-
IBM和耶路撒冷Hadassah联合建立企业加速器为创业公司提供支持
中欧时间2018年12月4日,IBM以色列分部和耶路撒冷的Hadassah Medical Center(以下简称Hadassah)联合建立了一个企业加速器,据以色列出版