数不清的气味都是由相对较少的基因的不同三维排列识别出来的
称之为基因组鼻子。与释放气味的花香不同,基因组节点——嗅觉受体基因的三维空间排列——帮助我们识别它们。不同的3D排列是如此有效,即使我们只有400个专门的嗅觉受体基因,它们也能让我们分辨一万亿种不同的气味。
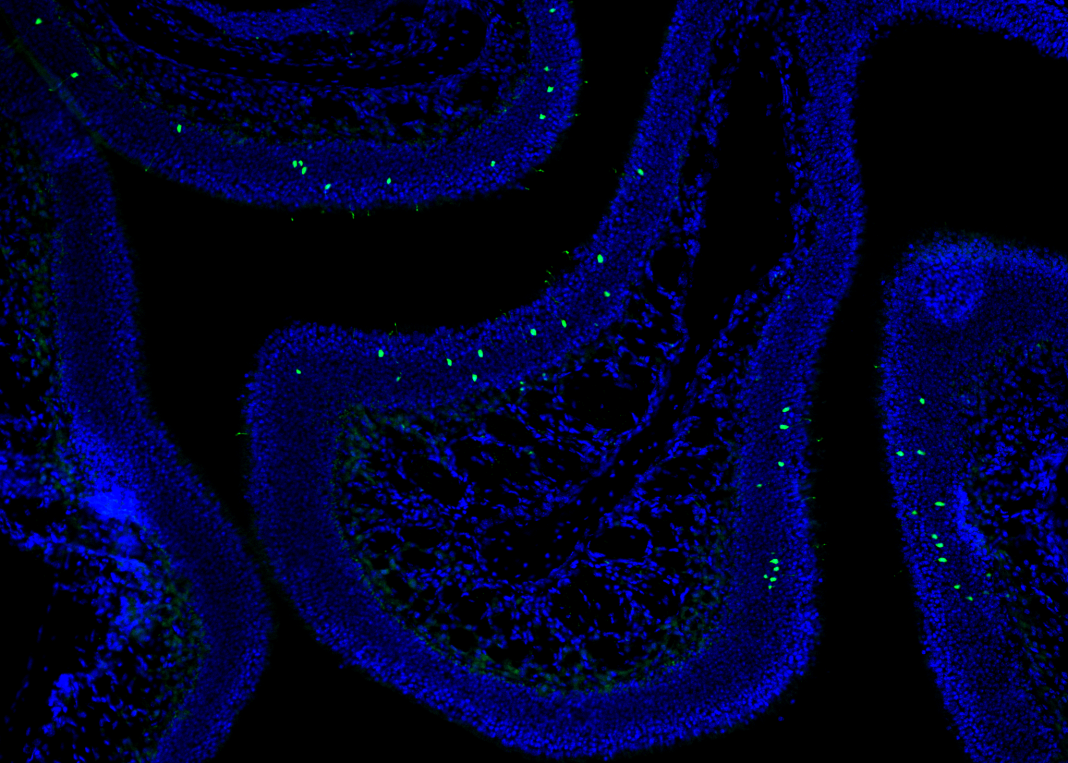
哥伦比亚大学(Columbia University)科学家最近发现的这种3D排列方式,有助于解释1000万个特定嗅觉神经元中的每一个是如何只表达一个嗅觉受体基因的,从而导致嗅觉神经元类型在嗅觉上皮细胞中的随机分布——如果你愿意,这是一种高阶的气味。
组织级和细胞级排列的基础是包含染色体到染色体接触的基因组级排列。为了捕捉这些接触者的气味,哥伦比亚大学Stavros Lomvardas博士实验室的科学家们使用了Hi-C,一种捕捉染色体构象的基因组测序技术。
哥伦比亚大学的研究小组于1月9日在《自然》杂志上发表了一篇题为《LHX2-和ldb1介导的反式相互作用调节嗅觉受体的选择》的文章。这篇文章描述了基因组如何协调每个神经元中这些基因的调节,从而产生探测我们所经历的气味所需的生物多样性。
“我们已经确定了一种基因组机制,通过这种机制,数量有限的基因最终可以帮助区分数量近乎无限的气味,”隆瓦尔达斯断言。特别是,科学家们明确了“每个神经元一个基因”的规则。
嗅觉,也被称为嗅觉,是一种复杂得令人难以置信的东西。我们鼻子里的感受器不仅要识别一种气味,还要测量它的强度,扫描我们的记忆以确定它是否曾经遇到过,并确定它是令人愉悦的还是有毒的。
嗅觉感受器神经元,一种特殊的神经细胞,从鼻子到大脑,使这一切成为可能。尽管每个神经元都包含400个专门的嗅觉受体基因,但每个神经元中只有一个基因是活跃的。更让人困惑的是:活跃的基因似乎是随机选择的,而且每个神经元都不一样。
这种不寻常的基因活动模式,即“每个神经元一个基因”规则,长期以来一直是Lomvardas等科学家研究的焦点。事实上,几十年来,破译每个嗅觉受体神经元是如何激活这些基因中的一个,以及这个过程是如何产生如此美妙的嗅觉感觉的,一直是个谜。
“在老鼠的基因组中,嗅觉受体基因分布在大约60个不同的位置——在彼此相距很远的不同染色体上,”Kevin Monahan博士说,他是Lomvardas实验室的博士后研究科学家,也是这篇论文的第一作者之一。老鼠大约有1000个嗅觉受体基因,是人类的两倍多,这可能表明老鼠的嗅觉更灵敏。
传统上,人们认为位于不同染色体上的基因很少相互作用。通过使用一种叫做原位Hi-C的新的基因组测序技术,Lomvardas博士和他的团队最近发现,染色体之间的相互作用比预期的要频繁得多。
《自然》杂志的这篇文章的作者写道:“在荧光激活的细胞分类的嗅觉感觉神经元及其祖细胞上使用原位Hi-C捕捉染色质构象表明,来自18条染色体的嗅觉受体基因簇产生特异性和鲁棒性的染色体间接触,这种接触随着细胞分化而增加。”“这些接触是由基因间嗅觉受体增强剂(‘希腊岛’)协调的,它们首先促进嗅觉受体隔间的形成,然后形成一个多染色体超增强剂,与单个活跃的嗅觉受体基因相关联。”
原位Hi-C在很大程度上是革命性的,因为它让我们能够以3D方式绘制活细胞内的整个基因组,”最近刚从Lomvardas实验室毕业的博士候选人、论文的第一作者之一Adan Horta说。“这给了我们基因组在特定时间点的快照。”
“希腊岛结合的转录因子LHX2和受体蛋白LDB1调控嗅觉受体室、希腊岛中心和嗅觉受体转录的组装和维持,”这篇文章的作者补充说,“为基因表达中转运相互作用的作用提供了机制上的见解和功能上的支持。”
研究人员拍摄的快照显示,在选择嗅觉受体基因之前,位于不同染色体上的嗅觉受体基因簇在身体上向每一个方向移动。在这些基因聚集在一起后不久,另一种被称为增强子的基因元素聚集在一个单独的三维空间中。增强子本身不是基因,而是调节基因的活性。
奥尔塔说:“我们之前发现了一组增强剂,我们给这些位于各种嗅觉受体基因附近的希腊岛屿命名。”这项研究表明,这些增强剂产生的热点活动,以调节“选择”嗅觉受体基因。
研究小组还发现Ldb1蛋白在这一过程中起着关键作用。它把希腊岛屿连在一起,使它们能够启动一种特殊的嗅觉受体基因,然后作为一个团队来解释手边的特殊气味。
“这些基因团队赋予嗅觉系统以多种方式作出反应的能力,”莫纳汉说。“这一过程的灵活性有助于解释我们是如何轻松地学习和记忆新气味的。”
尽管研究人员的发现只针对嗅觉,但它可能对其他在染色体间相互作用中发挥作用的生物学领域产生影响。
Lomvardas说:“染色体之间的相互作用可能是基因组转移的罪魁祸首,这种转移被称为基因组易位,已知会导致癌症。”“我们在嗅觉感受器神经元中看到的三维变化,能塑造其他细胞的活动吗?”这是一个我们希望探索的开放问题。
推荐内容
-
塔利班为什么仇恨女人?911和塔利班有关系吗?塔利班对女性有多残
了解过塔利班历史的朋友就知道,在塔利班的领导下女性生活在水深火热中,地位非常的低,甚至连一个人打出租车的权利都没有。那么,塔利...
-
本土新增191+825,最新中高风险地区汇总
本土新增191+825,最新中高风险地区汇总 原标题:本土新增191+825,最新中高风险地区汇总
-
8月12日武汉市疫情最新数据公布 武汉昨日新增新冠肺炎确诊病例4例
温馨提示:一旦出现发热、干咳、乏力、鼻塞、流涕、咽痛、嗅觉味觉减退、结膜炎、肌痛和腹泻等症状,应及时按规范程序就诊,并主动告知1...
-
身体有癌,脸部先知?若脸部三种“信号”,可能肝癌来袭
身体有癌,脸部先知?若脸部三种“信号”,可能肝癌来袭 原标题:身体有癌,脸部先知?若脸部三种“信号”
-
不会擀面的不用愁,剪刀一剪超简单,吃起来劲道滑爽,三碗不够吃
不会擀面的不用愁,剪刀一剪超简单,吃起来劲道滑爽,三碗不够吃 原标题:不会擀面的不用愁,剪刀一剪超简
-
战疫过程“全覆盖”,抗新冠病毒的单克隆中和抗体到底是何方神圣
战疫过程“全覆盖”,抗新冠病毒的单克隆中和抗体到底是何方神圣?6000字长文深度解析丨奇点深度 原标题:
-
美国累计确诊78万 英国新增确诊4676例
新冠病毒持续蔓延,一些国家的疫情形势仍不容乐观。据美国约翰斯·霍普金斯大学疫情实时监测系统显示,截至北京时间4月21日6时30分左右...
-
FDA推出连续制造指南 制药业将迎大变革
在过去很长一段时间,制药行业以严格监管和法规要求过于保守而被行业所诟病。甚至有专家断言-制药行业是21世纪最缺乏创新性的行业之一。想
-
74岁大爷用5千双筷子搭出黄鹤楼 网友:这才是真正的高手在民间!
关于74岁大爷用5千双筷子搭出黄鹤楼的这个话题,相信小伙伴们是非常有兴趣了解的,因为这个话题是目前网络上非常火热的,既然大家都想要了
-
科学家揭示了疱疹病毒如何睡眠和醒来
病毒是棘手的野兽。这些亚显微病原体中的一些可以在人体内进入睡眠状态,基本上无限期地从免疫系统中隐藏,只是为了重新激活并在以后引...