CAR T细胞疗法获准用于治疗某些B细胞急性淋巴细胞白血病的儿童和青少年
FDA(食品和药物管理局)发布了一项具有历史意义的行动,使美国首个基因疗法问世,为治疗癌症和其他严重威胁生命的疾病开辟了新途径。
FDA批准Kymriah(Tisagenlecleucel)用于某些患有急性淋巴细胞白血病(ALL)的小儿和成年青年患者。
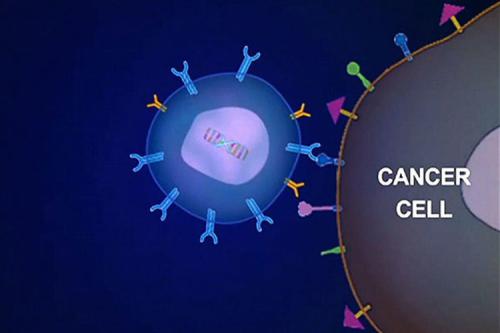
Kymriah是一种基于细胞的基因疗法,已在美国获准用于治疗难治性或第二次或更晚复发的B细胞前体ALL的25岁以下患者。
Kymriah是一种基因修饰的自体T细胞免疫疗法。每个剂量的Kymriah是使用个体患者自己的T细胞(一种称为淋巴细胞的白细胞)创建的定制治疗方法。
收集患者的T细胞并将其发送到制造中心,在这里对其进行基因改造,使其包含一个新基因,该基因包含一种特异性蛋白(嵌合抗原受体或CAR),该蛋白指导T细胞靶向并杀死具有以下功能的白血病细胞表面上的特定抗原(CD19)。
一旦细胞被修饰,它们便被注入患者体内以杀死癌细胞。
急性淋巴细胞白血病是骨髓和血液的癌症,其中人体产生异常的淋巴细胞。该疾病进展迅速,是美国最常见的儿童癌症。
国家癌症研究所(NCI)估计,每年约有3,100名20岁以下的患者被诊断出患有ALL。
急性淋巴细胞白血病可以是T细胞或B细胞起源的,最常见的是B细胞。
Kymriah已获批准用于B细胞ALL的小儿和成年青年患者,适用于癌症对初始治疗无反应或在初始治疗后复发的患者,估计约有15-20%的患者会出现这种情况。
Kymriah的安全性和有效性在一项针对63名患有复发性或难治性B细胞前体急性淋巴细胞白血病的儿童和年轻成人患者的多中心临床试验中得到了证明。
治疗三个月内的总缓解率为83%。
Kymriah的治疗有可能引起严重的副作用。它带有针对细胞因子释放综合征(CRS)的有框警告,CRS是对CAR T细胞的激活和增殖(引起高烧和流感样症状)以及神经系统事件的系统性反应。
CRS和神经系统事件都可能危及生命。
Kymriah的其他严重副作用包括严重感染,低血压,急性肾损伤,发烧和氧气减少(缺氧)。
多数症状在输入Kymriah后的1到22天内出现。
由于CD19抗原也存在于正常B细胞上,而Kymriah也会破坏那些产生抗体的正常B细胞,因此长时间感染的风险可能会增加。
FDA还扩大了Actemra(Tocilizumab)的批准,以治疗CAR T细胞诱导的2岁以上患者的严重或危及生命的CRS。
在接受CAR-T细胞治疗的患者的临床试验中,69%的患者在一两剂Actemra后两周内CRS完全消失。
由于存在CRS和神经系统事件的风险,Kymriah已被批准采用风险评估和缓解策略(REMS),其中包括确保安全使用的要素(ETASU)。
FDA要求分配Kymriah的医院及其相关诊所必须经过特殊认证。作为该证书的一部分,要求对参与Kymriah处方,分发或管理的人员进行培训,以识别和管理CRS和神经系统事件。
此外,要求经过认证的医疗保健机构具有适当的方案,以确保仅在确认可立即给予Tocilizumab后才将Kymriah给予患者。
REMS计划规定,应告知患者输注后CRS的体征和症状以及神经系统毒性-以及在接受Kymriah治疗后如果出现发烧或其他不良反应,应立即返回治疗部位的重要性。
为了进一步评估长期安全性,诺华还需要进行一项上市后观察研究,研究对象包括接受Kymriah治疗的患者。(Xagena)
推荐内容
-
9月1日越南胡志明平阳疫情最新数据公布 越南昨日新增确诊12607例
想必大家都知道,越南社会主义共和国,简称越南(Vietnam),是亚洲的一个社会主义国家。那么,你知道越南目前疫情什么情况吗?据越通社消息
-
小偷自封盗王还留字条叫板警察是什么情况?结果悲剧了
小偷法律地位的提升被认为是一种法律的进步,体现了法律对人身权的重视与保护。小偷,还可以指情节较轻的偷窃行为,如:小偷小摸。那么,对
-
王者荣耀七夕皮肤 七夕情人节返场皮肤介绍来了
【 王者荣耀七夕皮肤 】关于王者荣耀8月25日七夕更新内容,蔡文姬的6元特价皮肤限时优化返场的这个话题,相信小伙伴们是非常有兴趣了解的,
-
防疫必备品来了 百威将生产洗手液
酒精不仅可以用来生产酒,在此次新冠疫情中也成了人们防疫必备。3月23日,啤酒巨头百威宣布,由于拥有大量酒精原材料,将开始生产消毒洗手
-
揭开控制细胞生长和大小的机制
所有活细胞,从简单的酵母到人脑细胞,都能调节它们的生长速度和最终的大小和形状。然而,他们如何做到这一点是生物学的基本奥秘之一。1...
-
搜狐医药 | 北京海淀、顺义各增加5例阳性,昌平1例
搜狐医药 | 北京海淀、顺义各增加5例阳性,昌平1例 原标题:搜狐医药 | 北京海淀、顺义各增加5例阳性
-
今日生猪价格多少钱一斤?全国猪价最新今日涨跌一览表
【导读】猪肉是我们日常生活中常见的食物,几乎每个人每天都会去吃它,要知道生猪价格跌跌不休。在中小散养猪户不知道何去何从的时候,...
-
高血压不能吃大蒜?医生提示:想要血压稳定,尽量少碰这3种食物
高血压不能吃大蒜?医生提示:想要血压稳定,尽量少碰这3种食物 原标题:高血压不能吃大蒜?医生提示:想
-
高血糖不吃药,如何降到正常值?来看看本文的全面分析
高血糖不吃药,如何降到正常值?来看看本文的全面分析 原标题:高血糖不吃药,如何降到正常值?来看看本文
-
用于再生研究的新版RNA-Seq
来自植物(如枝或叶)的组织可以生长,形成一种全新的植物。这种再生能力是食品生产和未来医学的梦想,负责植物再生的基因可以提供对具有...