Keytruda药联合仑伐替尼治疗3种晚期癌症
默沙东与合作伙伴卫材近日在第33届癌症免疫治疗学会(SITC)年会上公布了PD-1肿瘤免疫疗法Keytruda(pembrolizumab,帕博利珠单抗)与分子靶向疗法Lenvima(lenvatinib,仑伐替尼)联合治疗3种不同类型肿瘤(转移性非小细胞肺癌[NSCLC]、转移性黑色素瘤、转移性尿路上皮癌)的新数据。


这些数据来自于Ib/II期临床研究Study 111/KEYNOTE-146。对上述3种类型肿瘤治疗的中期分析显示,Keytruda与Lenvima联合用药显示出令人鼓舞的抗肿瘤活性,并且耐受性良好。数据支持了对该组合进行进一步的评价。目前,Keytruda尚未获任何监管部门批准与Lenvima联合用药治疗任何类型肿瘤。
卫材肿瘤业务副总裁兼首席药物创造官Takashi Owa博士表示,“我们越来越相信,对Lenvima与Keytruda联合治疗非小细胞肺癌、黑色素瘤、尿路上皮癌的新临床研究数据的初步分析结果继续证实了这种联合方案的潜力。通过与默沙东合作,我们正在尽最大的努力为需要新治疗方案的患者提供这一组合。”
默沙东肿瘤学临床研究副总裁Jonathan Cheng博士表示,“这些早期积极数据支持将Keytruda与Lenvima联合治疗一系列不同癌症的临床开发策略,我们期待继续与卫材合作开展广泛的临床研究,以评估这两种药物的联合用药方案,从而改善癌症患者的治疗效果。”
Study 111/KEYNOTE-146是一项多中心、开放标签、单臂、Ib/II期篮子研究(NCT02501096),评估了Lenvima(20mg/天)与Keytruda(200mg,每3周一次静脉输注)组合疗法在所选定实体肿瘤(转移性子宫内膜癌、转移性头颈部癌、转移性黑色素瘤、转移性NSCLC、转移性肾癌和转移性尿路上皮癌)。入组研究的患者不基于PD-L1肿瘤表达状态预先选择。Ib期研究的主要终点是确定Lenvima与Keytruda联合使用的最大耐受剂量。II期研究的主要终点是研究员基于免疫相关RECIST(irRECIST)评估的第24周的客观缓解率(ORR),次要终点包括ORR、无进展生存期(PFS)、病情完全缓解或部分缓解患者中的缓解持续时间(DOR)。
Lenvima与Keytruda联合治疗NSCLC:
至2018年3月1日数据截止,21例既往未接受治疗或曾接受最多2种疗法的转移性NSCLC患者入组了II期队列。根据irRECIST评估的第24周的ORR为33.3%(95%CI:14.6-57.0)。次要终点方面,根据irRECIST评估的中位PFS为5.9个月(95%CI:2.3-13.8),12个月PFS生存率为29.0%(95%CI:10.2-51.0)。中位DOR为10.9个月(95%CI:2.4-不可估计)。10例患者(48%)发生3级治疗相关不良事件(TRAE),1例(5%)发生4级TRAE。最常见的TRAE(任何级别,发生率≥30%)为食欲下降(67%)、疲劳(62%)、甲状腺功能减退(43%)、腹泻(43%)、蛋白尿(43%)、关节痛(33%)和高血压(33%)。研究中发生1例治疗相关死亡。Lenvima与Keytruda联合用药的一般耐受性良好,并且表现出有希望的临床活性,无论肿瘤PD-L1状态如何。这些数据支持了对该组合疗法治疗转移性NSCLC的进一步评估。
Lenvima与Keytruda联合治疗晚期黑色素瘤:
至2018年3月1日数据截止,21例既往未接受治疗或曾接受最多2种疗法的转移性黑色素瘤患者入组了研究。根据irRECIST评估的第24周的ORR为47.6%(95%CI:25.7-70.2)。次要终点方面,中位PFS为5.5个月(95%CI:2.6-15.8)、12个月PFS生存率为24.7%(95%CI:14.5-56.0)。中位DOR为12.5个月(95%CI:2.7-不可估计)。所有患者经历至少一次治疗相关不良事件(TRAE),3级或4级TRAE发生于14例患者(67%)。最常见的TRAE(任何级别,发生率≥30%)为疲劳(52%)、食欲下降(48%)、腹泻(48%)、高血压(48%)、发声困难(43%)、恶心(43%)、关节痛(33%)和蛋白尿(33%)。研究中没有发生治疗相关死亡。Lenvima与Keytruda联合用药的一般耐受性良好,并且表现出令人鼓舞的临床活性。这些数据支持了对该组合疗法治疗转移性黑色素瘤的进一步评估。
Lenvima与Keytruda联合治疗尿路上皮癌:
至2018年3月1日数据截止,20例既往未接受治疗或曾接受最多2种疗法的转移性尿路上皮癌患者入组了研究。根据irRECIST评估的第24周的ORR为25%(95%CI:9-49)。次要终点方面,中位PFS为5.4个月(95%CI:1.3-不可估计)。18例患者(90%)经历治疗相关不良事件(TRAE),3级或4级TRAE发生于10例患者(50%)。最常见的TRAE(任何级别,发生率≥30%)为蛋白尿(45%)、腹泻(40%)、高血压(35%)、疲劳(30%)、甲状腺功能减退(30%)。研究中发生1例治疗相关死亡。Lenvima与Keytruda联合用药的一般耐受性良好,并且表现出令人鼓舞的抗肿瘤活性,并与肿瘤PD-L1表达状态无关。这些数据支持了对该组合疗法治疗转移性尿路上皮癌的进一步评估。
Lenvima:中国10年来批准一线治疗肝细胞癌的首个新药
Lenvima是由卫材内部研发的一种口服多受体酪氨酸激酶(RTK)抑制剂,具有新颖的结合模式,除抑制参与肿瘤增殖的其他促血管生成和致癌信号通路相关RTK(包括血小板衍生生长因子[PDGF]的受体PDGFR,KIT和RET)外,还能够选择性抑制血管内皮生长因子(VEGF)受体(VEGFR1、VEGFR2、VEGFR3)和成纤维生长因子(FGF)受体(FGFR1,FGFR2,FGFR3,FGFR3)的激酶活性。
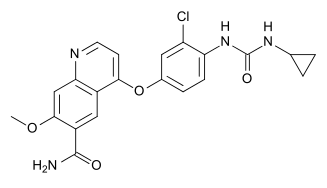
lenvatinib分子结构(来自维基百科)
2018年3月,默沙东与卫材达成战略合作,共同推进Lenvima的全球开发和商业化。截止目前,Lenvima已获包括美国、日本、欧洲和亚洲的50多个国家和地区批准,用于难治性甲状腺癌,并获包括美国和欧盟在内的40多个国家和地区批准联合依维莫司(everolimus)用于肾细胞癌的二线治疗。此外,Lenvima还获包括日本、美国、欧洲、中国及其他国家和地区批准治疗肝细胞癌(HCC)。
在中国市场,Lenvima于2018年9月初获批准,作为一种单药疗法,用于治疗既往未接受过全身系统治疗的不可切除HCC患者。中国是全世界肝癌患者最多的国家,此次批准,使Lenvima成为过去10年来在中国获批一线治疗肝细胞癌的首个新药。
推荐内容
-
心理知识:社交恐惧症自测题
生活中,不管我们在跟自己独处还是跟别人相处的过程中其实我们会发现心理对一个人的影响是很大的。因此当我们发现自己有心理疾病的倾向...
-
如何成为合格领导者
现实生活中,我们很难揣测出一个人的心理活动。但是我们可以根据一些知识的细节,去假设判断一些人的心理,也包括对自己的心理的认知。...
-
心理知识:大多数人都会误解的心理学知识
日常生活中,我们会发现一个高情商的人是很受欢迎的。那么如何做一个情商高的人呢?其实只要懂得一点心理观察,善于捕捉一些细节,我们...
-
NIH审查发现非药物方法可有效治疗常见疼痛状况
今天在Mayo Clinic Proceedings上发表的美国临床试验回顾数据表明,某些最受欢迎的补充健康方法,例如瑜伽,太极拳和针灸,似乎是帮助管
-
引发心理疾病的原因有哪些
心理这个词最近被提及的频率是越来越高了。其实在国外有一个职业特别吃香,那就是心理医生。为什么呢?因为国外特别是西方有几个国家已...
-
心理知识:关于梦的20个心理问答
心理活动是每个人都有的。然而这样一个别人不知道的思想角落,往往容易被他人忽视。所以我们自身必须时刻关注自己的内心需求,不能让自...
-
吃水果真的有助于感冒恢复吗?需要好好科普
面对流言,希望我们第一时间想到的是寻找官方回应。而不是着急着把流言传播出去,毕竟现在网络相关的法律法规都出台了,网络上传播谣言...
-
科学家确定了关键的汉坦病毒受体
根据今天发表在 自然 杂志上的一项研究,一个全球研究小组已经确定了一种与汉坦病毒肺综合征(HPS)有关的关键蛋白,这是一种严重的,有时
-
如何对待负面情绪
社会的发展越来越快,大家现在也慢慢开始关注一个人的心理健康。因为外界事物的巨大变化,很多人跟不上变化的脚步就会产生心理落差感从...
-
心理知识:路西法效应——好人是如何变成恶魔的
随着社会压力的不断加大,人们现在把越来越多的目光放到了一个人的心理情况上。确实,每个人的抗压指数是有限的,一个平时看着正常的人...