分子开关不仅仅是开启或关闭
GTP酶构成一个非常大的蛋白质家族,其成员参与控制细胞生长,分子运输,合成其他蛋白质等。尽管GTP酶具有许多功能,但它们遵循共同的循环模式(图1)。GTP酶的活性受控制其结合和水解鸟苷三磷酸(GTP)至鸟苷二磷酸(GDP)的能力的因素调节。到目前为止,一般的假设是GTP酶在与GTP结合时是活跃的或“开启”的,并且与GDP复合时是非活性的或“关闭”的。因此,GTP酶有时被称为分子“开关”。
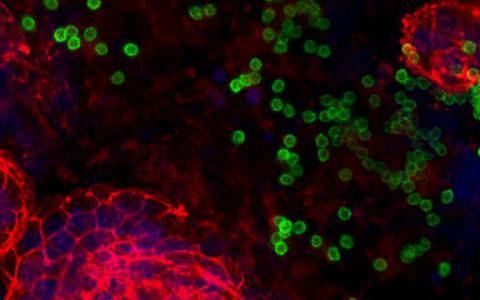
细菌翻译延伸因子EF-Tu是GTP酶,其在细菌中蛋白质的合成过程中起关键作用,因为该因子将构建细胞蛋白质的氨基酸转运至细胞蛋白质合成工厂即核糖体。先前使用X射线晶体学的结构研究表明,EF-Tu以两种明显不同的三维形状出现,这取决于因子是“开启”(即与GTP结合)还是“关闭”(即与GDP结合)(图2)。因此,GTP / GDP的约束一直被认为是该因子结构构象的决定性因素。
然而,奥胡斯大学分子生物学和遗传学系以及两所美国大学的研究人员之间的研究合作表明,EF-Tu的结构和功能,以及可能还有其他GTP酶的结构和功能,远比以前假设的要复杂得多。在SørenThirup的研究小组中,大肠杆菌EF-Tu的X射线晶体学分析表明,与GTP变体GDPNP结合的EF-Tu也可以在“关闭”状态下发生,其特点是结构更开放。夏洛特克努森博士与美国研究人员合作,获博士学位。学生Darius Kavaliauskas使用一种特殊形式的荧光显微镜进行了进一步的研究,这使得观察溶液中各个EF-Tu分子的空间结构成为可能。
EF-Tu用荧光供体和荧光受体标记。当用特定波长的光照射供体时,光将被吸收并转换成具有新波长的光。受体将捕获光并以第三波长重新发射,如果它靠近供体。在共聚焦显微镜中测量透射光,由此可以确定溶液中数千个分子的EF-Tu分子中供体和受体之间的距离,从而提供关于EF-Tu的动态方面的信息。
GTP酶比假设更具动态性
该研究表明,当因子与GDP或GDPNP的变化相关时,解决方案中的EF-Tu不是固定结构,因此应分别“关闭”或“开启”。相反,EF-Tu通过作为结构的混合物出现而变得非常动态。根据X射线晶体学研究,当将GDPNP包括在溶液中时,这种趋势最为明显。只有当与核糖体结合时,EF-Tu才会呈现预期的活性形式(图2,左)。
结果表明,在未来,GTP酶应被视为更灵活的分子,不仅“开”或“关”。GTP酶是明显的药物靶点:例如,细菌感染原则上可以通过抑制EF-Tu来治愈,而GTP酶ras p21在所有癌症的约30%中被错误调节 - 尤其是肺,结肠和胰腺中特别致命的形式。 。然而,到目前为止还没有可能开发出针对这两种靶标的可用药物,但发现GTP酶的高灵活性可能有助于改变这种情况。
推荐内容
-
8月14日越南胡志明疫情最新实时数据公布 越南昨日新增确诊9180例
【提醒】当前疫情形势严峻复杂,防控不能放松。要时刻保持个人防护意识,支持配合防控措施,主动接种新冠病毒疫苗。据越通社消息 当地时间
-
2021江苏什么时候入梅出梅 附江苏2021入梅出梅时间表
淅淅沥沥的小鱼虽然衬的江南小镇有别样的风景,但是闷热潮湿让人心生烦躁。那么,对于江苏的入梅时间,你知道吗?2021江苏入梅出梅一、2021
-
12月7日上海浦东新区疫情数据公布 今日,已筛查其在沪相关人
【摘要】非必要不外出、不出行、不远行。如果您28天内有境外或14天内有国内中高风险区的旅居史,请及时向社区报告。上海发布微信公众号12月
-
7月30日株洲云龙示范区疫情最新数据公布 株洲云龙示范区新增4
株洲云龙示范区新增4例新冠肺炎无症状感染者是怎么回事?什么情况?据悉消息显示,7月30日,株洲市云龙示范区新增报告4例新冠肺炎无症状感染
-
11月24日承德双桥疫情最新消息公布 15时起对承德工业学校等5地
承德双桥:15时起对承德工业学校等5地解除封闭管控。据消息显示,承德市双桥新冠肺炎疫情防控工作领导小组(指挥部)办公室发布通告称,经双
-
麦当劳起诉前CEO 麦当劳这是流年不利?
【导读】麦当劳起诉前CEO引发热议,近来麦当劳的负面消息可以说是频出,从国外麦当劳有小孩吃出一次性口罩,到某机构检测出麦当劳包装有致
-
滴滴回应女子性骚扰男司机 女乘客性骚扰男司机行为属实
都说性骚扰不分性别,虽然现如今大多数都是女性遭遇性骚扰,但是还是有一小部分男性也会遭遇来自女性的性骚扰也同样引人关注,近来女子...
-
研究人员建立了研究健康组织中隐孢子虫的新工具
华盛顿州立大学的研究人员开发了一种研究隐孢子虫的新方法,隐孢子虫是一种水性胃肠道寄生虫,现已被公认为是全球幼儿可能危及生命的腹...
-
遗传科学家确定人类大脑发育的关键基因
美国人类遗传学杂志报道的一项新研究证实,一种名为USP9X的基因对人类大脑发育的早期阶段至关重要。USP9X已被研究人员研究了十多年,但近年
-
哈维尔穿越2027最新视频 哈维尔2027穿越事件是真的吗始末介绍
关于西班牙哈维尔穿越是真的吗?哈维尔2027最新视频的这个话题,相信小伙伴们是非常有兴趣了解的,因为这个话题是目前网络上非常火热的,既