加强新基因编辑技术使用的效率 规则
约翰霍普金斯大学的科学家们开发了一种简化的方法,并伴随着使用称为CRISPR的基因切割工具将新DNA序列引入细胞的效率“规则”。科学家们说,这种方法基于对小鼠胚胎和数千种人类细胞的测试,可以提高基因组编辑的一致性和效率。
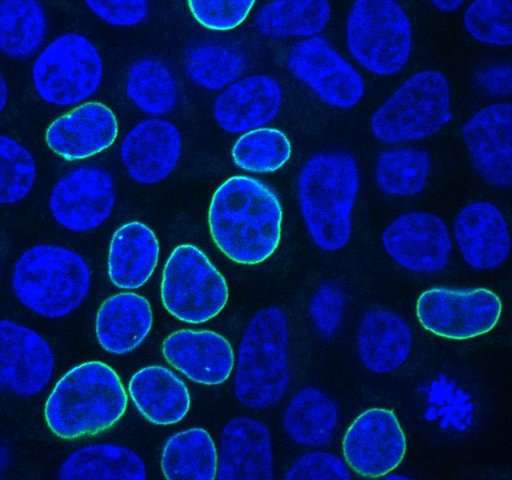
新方法及其发展在11月28日的“美国国家科学院院刊”网络版上有所描述。“CRISPR是一种帮助科学家修改基因组,预测某些特性的结果并研究它们的工具,但该工具本身只会在基因组中产生断裂。它不能控制新DNA序列如何插入基因组中,” Geraldine Seydoux,博士,亨廷顿谢尔顿分子生物学和遗传学系医学发现教授,约翰霍普金斯大学医学院基础研究副主任,以及霍华德休斯医学研究所的研究员。“我们开始研究细胞如何修复由CRISPR诱导的断裂,目的是利用细胞的天然DNA修复过程在基因组中引入新的序列。我们惊讶地发现细胞很容易从外源DNA复制序列来修复DNA断裂,只要外国DNA是线性的,“Seydoux补充道。“通过研究在修复过程中如何复制外源DNA片段,我们提出了一些简单的规则,使基因组编辑尽可能高效,优化工具,并充满信心地完成工作。”
作为有效切割DNA的工具,CRISPR在过去五年中在科学家中广受欢迎,它代表了有规律的间隔短回文重复序列。它适用于哺乳动物细胞,来自细菌细胞中的天然病毒防御过程,涉及在病毒DNA中产生致死性切割。从本质上讲,该工具是一套流线型的分子“剪刀”。
科学家们普遍认为,细胞通过插入一组随机核苷酸(DNA的化学构建块)来修复DNA断裂。这通常会破坏位于DNA断裂点的任何基因。科学家们也熟知,有时,细胞使用不同的来源 - 来自另一片DNA的序列,或“供体”DNA来密封DNA的断裂。然而,新的“供体”序列不能自身插入基因组中的空白空间。相反,新的供体DNA需要在每一端都有一种胶带,以帮助它粘在切口所形成的间隙内。科学家将这种胶带称为供体DNA的“同源”臂。
同源臂由与DNA的完整部分重叠的核苷酸组成,具有匹配的遗传密码。这有助于供体DNA“粘附”到完整的DNA上。然而,科学家认为使用供体DNA作为修复基因组的低效方法,假设它需要长同源臂,特别是当插入长DNA序列时,以及单链或环状DNA,这些很难用于长尺寸。随着科学家们获得更多的CRISPR经验,Seydoux说:“有关供体DNA的最佳设计规则和同源臂长度的问题出现了。”
为了寻找这些问题的答案,约翰霍普金斯大学的科学家将供体DNA的各种组合插入到人类胚胎肾细胞中,这些细胞以其良好的生长能力和频繁用于癌症研究而闻名。科学家使用供体DNA和一个编码荧光蛋白的基因,当基因插入成功时,荧光蛋白在细胞核膜上发出绿光。
约翰霍普金斯大学的研究员Alexandre Paix发现线性DNA片段作为供体非常有效,并且比人类细胞中的环状DNA(称为质粒)效率高2到5倍。“线性DNA很容易在实验室中使用PCR进行制备,”Paix说,他指的是用于扩增DNA的聚合酶链反应工具。
Paix还测试了不同长度的同源臂。他发现同源臂的最佳位置长度约为35个核苷酸,比科学家通常使用的短得多。具体而言,发现长度为33至38个核苷酸的同源臂与具有518个核苷酸的同源臂一样成功,在最佳条件下产生10%至20%的成功编辑。相反,当科学家测试长度为15和16个核苷酸的同源臂时,插入成功率下降了一半。他们在人类基因组的三个不同位置重复这些结果。
他们还发现,新插入的序列,不包括同源臂,长度可达1000个核苷酸。
该团队的成功率在10%至50%之间,插入片段的长度范围为57至993个核苷酸。较短的序列比较长的序列更成功插入。例如,分别在45.4%,23.5%和17.9%的时间内成功插入长度为57,714和993个核苷酸的新序列。超过1,000个核苷酸,具有1,122和2,229个核苷酸的新插入物几乎没有成功 - 约0.5%的时间。“在这样的规模下,引入编辑所需的供体 DNA 数量变得非常困难。细胞倾向于”扼杀“如此多的DNA,”Seydoux说。
最后,研究小组还发现,当新序列位于距离CRISPR切割位点30个核苷酸内时,编辑成功率达到峰值。“超过30个核苷酸,插入是不可行的,”Seydoux说。“这些参数应该适应科学家正在寻求编辑的大多数基因。事实上,大多数实验只涉及编辑靠近CRISPR切割位点的2-3个核苷酸,”Seydoux补充道。
研究小组还测试了相同的方法是否适用于小鼠胚胎。使用具有36 个核苷酸同源臂的PCR片段,该团队成功地将编码荧光蛋白的739个核苷酸长的序列插入到87个(31%)小鼠胚胎中的27个中。Seydoux的研究团队已经开始使用修复规则研究线虫(Caenorhabditis elegans)中的DNA,这是一种蠕虫,研究人员正在研究修复规则是否适用于其他类型的人体细胞。在指南被广泛采用之前,Seydoux说它们应该在更多的人类细胞类型和其他生物体中进行测试。
推荐内容
-
大过年的,莫让传言给“年味”添堵? 真相来了
大过年的,莫让传言给“年味”添堵? 真相来了随着互联网时代的到来,讯息传播效率飞速提高,但其中很多消息还没被证实真实性就大范围...
-
超暖心!3岁娃雪地里赤脚独自找妈妈 民警将其抱在怀里随后举动超暖
3岁娃雪地里赤脚独自找妈妈 民警将其抱在怀里随后举动超暖。近日一则关于3岁娃雪地里赤脚独自找妈妈 民警将其抱在怀里随后举动超暖的视频
-
安徽合肥一中学英语老师现场献唱场面壮观 温馨气氛令人感动
中学英语老师现场献唱 场面壮观引全校欢呼网友:开口即是王者。想必今天大家最关注的话题莫过于中学英语老师现场献唱场面壮观,一开口引全
-
发现乳腺肿块别发愁!济南市中心医院乳腺疾病诊疗中心解难忧
发现乳腺肿块别发愁!济南市中心医院乳腺疾病诊疗中心解难忧 记者 王小蒙 通讯员 关天星日前,一位80岁老人发现一侧乳腺有肿物,转
-
共生细菌发现第三种鞭毛
学习大学的Takayuki Nishizaka教授和Yoshiaki Kinosita博士与AIST的Yoshitomo Kikuchi博士一起发现了一种无法预见的鞭毛介导的运动形式
-
减肥不吃主食和油?真实情况是怎样 明星减肥法别轻易尝试
随着互联网的快速发展,我们在获取信息的时候很容易被带跑方向。有时候真相也许并不是网上说的那样,所以我们必须要有自己的判断和独立...
-
38岁男网红娶73岁老太狂秀恩爱 接受采访忘关麦曝光荒唐对话引发众怒
38岁男网红娶73岁老太狂秀恩爱 接受采访忘关麦曝光荒唐对话。一名38岁男网红娶了74岁老太,两人婚后狂秀恩爱,近日他们接受采访时忘了关麦