IDH1抑制剂获优先审评资格
致力为癌症和罕见遗传病开发新疗法的Agios Pharmaceuticals公司日前宣布,美国FDA接受了Tibsovo(ivosidenib)的补充新药申请(sNDA),治疗携带IDH1基因突变,且不适用化疗的急性骨髓性白血病(AML)初治患者。该申请获得优先审评资格,有望在2019年6月21日之前得到批复。
AML是成人中最常见的急性白血病,疾病进展快速,五年生存率约为27%。化疗是目前的标准治疗,但大部分患者对化疗没有反应,进展为复发/难治性AML。在大约6%~10%的AML病例中,存在异柠檬酸脱氢酶-1(IDH1)基因突变,造成正常的血液干细胞分化受阻,引起发病。
作为“first-in-class”口服IDH1抑制剂,Tibsovo已于2018年获得FDA批准,治疗经检测携带易感IDH1突变的复发/难治性AML成人患者。
此次sNDA申请将Tibsovo上升为AML一线治疗。FDA对申请的批准基于ivosidenib剂量递增和扩展的1期临床试验。这项研究中不适用标准治疗的初治AML患者组数据已在2018年美国血液学学会(ASH)年会上发布。
值得一提的是,这一申请被FDA纳入实时肿瘤学审评(Real-Time Oncology Review)试点项目,允许FDA在申请正式提交之前获取临床试验数据,进而加快药物审评的速度。
“在Tibsovo被批准用于治疗复发/难治性AML后,短短不到7个月,我们正在与FDA的合作将它扩展为一线疗法。”Agios首席医学官Chris Bowden博士表示,“新确诊的AML患者如果不能接受标准治疗,目前只能采用姑息治疗。因此,他们急切需要新治疗方案。我们相信,携带IDH1突变的AML患者将会受益于这种靶向疗法。”
推荐内容
-
研究表明孕妇在透析方面的种族差异
由于生育能力受损,接受透析的妇女怀孕并不常见。辛辛那提大学(University of Cincinnati)的一项新研究发现,患有某些肾脏疾病的患者中,
-
基因组测序揭示了黑猩猩和倭黑猩猩之间的古老杂交
科学家们首次发现黑猩猩和倭黑猩猩(人类最亲近的亲戚)之间的古老基因混合,与人类血统的尼安德特人混合呈现出相似之处。今天发表于 科学
-
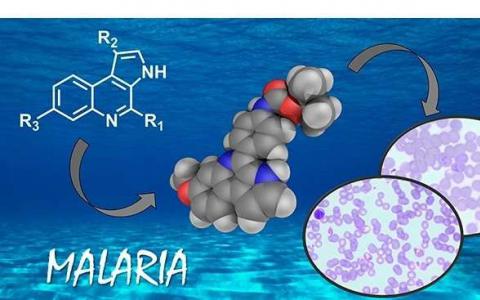
一种新的高效的和选择性的抗疟疾分子
一种新的实验室合成分子,基于在海洋滑翔细菌中发现的称为marinoquinolines的天然化合物,是开发新抗疟药物的有力候选者。在测试中,该分子
-
最早的人类迁移到阿拉伯半岛不需要新的改编
由马克斯普朗克人类历史科学研究所的科学家领导的一项新研究,发表于 自然生态学与进化论,表明非洲以外的早期人类传播并未涉及对极端环境
-
研究揭示了胰腺癌微环境中调节性T细胞与成纤维细胞之间的细胞串音
一个多学科的密歇根医学团队正在研究调节性T细胞在胰腺癌中的作用,并在小鼠模型中发现了一个新的潜在靶点,以改善对这种致命疾病的免疫...
-
械字号面膜不存在的?还有哪些坑依旧隐蔽
近年来,随着国民收入和大众对美的追求,各类医疗美容项目逐渐变得火热,之配套的产品也纷纷出现在消费者面前,械字号面膜正是随着这波...
-
当脂肪细胞改变颜色
在哺乳动物中,存在三种类型的脂肪组织。白色脂肪细胞主要位于身体的腹部和皮下区域,非常适合储存多余的能量。相反,米色和棕色脂肪细...
-
成像技术可以帮助对抗危害数百万海洋生物的疾病
海洋居住的海星,更准确地称为海星,正在成群结队地成为最近发现的一种叫做海星消耗疾病的综合症。幸运的是,去年夏天在西雅图和温哥华...
-
麻省理工学院的研究人员开发了分析大量细胞数据集的新方
数据采样方法制作了笨拙的生物数据集的草图,同时仍然捕获了细胞类型的完整多样性。艺术草图可用于以更简单的图像捕捉场景的细节。麻省...
-
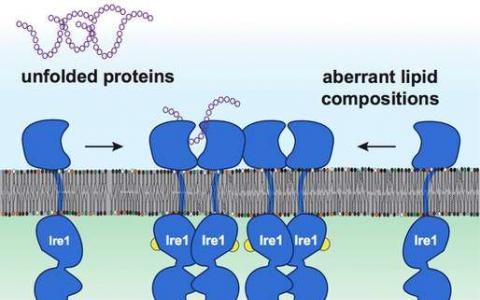
分子生物学家发现膜脂在健康和疾病中的积极作用
所有生长和分裂的活细胞都不断需要产生新的蛋白质和新的膜脂质。然而,人体的一些细胞专门用于分泌大量蛋白质。例如,浆细胞产生抵抗细...